국내 맥류에 발생하는 바이러스병 동시진단 방법
Simultaneous Detection of Barley Virus Diseases in Korea
Article information
Abstract
Barley mild mosaic virus (BaMMV), Barley yellow mosaic virus (BaYMV) and Barley yellow dwarf virus (BYDV) have been identified as an important causative agents for an economically important disease of winter barley in Korea. In this study, a multiplex reverse transcription polymerase chain reaction (mRT-PCR) method was used for the simultaneous detection. Three sets of virus-specific primers targeted to the capsid protein coding genes of BaMMV, BaYMV and BYDV were used to amplify fragments that were 594 bp, 461 bp, and 290 bp, respectively. Several sets of primers for each target virus were evaluated for their sensitivity and specificity by multiplex RT-PCR. The optimum primer concentrations and RT-PCR conditions were determined for the multiplex RT-PCR. The mRT-PCR assay was found to be a better and rapid virus diagnostic tool of specific barley diseases and potential for investigating the epidemiology of these viral diseases.
국내에 발생이 보고된 맥류 바이러스병은 보리누른모자이크병(Barley yellow mosaic virus, BaYMV, Barley mild mosaic virus, BaMMV), 보리위축병(Barley yellow dwarf virus, BYDV), 보리모자이크병(Soil-borne wheat mosaic virus, SBWMV), 보리줄무늬 모자이크병(Barley stripe mosaic virus, BSMV), 보리북지모자이크병(Barley Northern cereal mosaic virus, NCMV) 등이다(Lee, 1981; Park 등, 2003; So 등, 1997). 국립식량과학원에서는 2014년부터 2016년까지 3년간 국내 맥류 주 재배지인 전남북 및 경남북을 중심으로 밀, 보리 등 맥류에 바이러스병 발병을 조사하였다. 조사 결과 전남북 및 경남북 모든 지역에서 BaYMV가 확인되었고, 전남의 일부 지역에서는 BaYMV가 우점하면서 BaMMV와 복합 감염되어 피해를 주고 있는 양상을 나타내었다. 고성, 김제, 사천의 일부 지역에서는 BYDV가 확인되었다 (Bae 등, 2015; Lee 등, 2016). 최근 3년간의 조사 결과로서 국내 맥류 바이러스병 발생은 BaYMV, BaMMV 및 BYDV가 주로 발생하는 것으로 확인되었다. BaYMV, BaMMV는 토양전염성 곰팡이인 Polymyxa graminis (P. graminis)에 의해 전염되며, BYDV는 진딧물에 의해 전염된다(Adams 등, 1988, Ketta 등, 2012). 이들 바이러스병의 방제는 매개자인 P. graminis 또는 진딧물을 방제하여 바이러스병의 발생을 차단하고 있다(So 등, 1988; So, 1993). 국내 맥류 재배지에 가장 문제가 되는 BaYMV 및 BaMMV는 매개자인 P. graminis의 토양전염 특성으로 인해 방제가 매우 어렵다고 알려져 있으며, 현재까지 바이러스병은 일단 감염이 되면 치료와 방제가 매우 어려우므로 초기에 신속하게 진단하여 제거하는 것이 최선의 방제방법으로 알려져 있다(Chen 등, 1991; Kashiwazaki 등, 1989). 본 연구에서는 최근 국내 보리 재배에 가장 문제가 되는 BaYMV, BaMMV 및 BYDV 3종의 바이러스를 동시에 진단하는 방법을 확립하고 진단키트를 제작하였다. 맥류 바이러스병 동시진단방법은 진단에 필요한 시간, 노력 및 비용을 절감하고, 보리 바이러스병 저항성품종 육종을 위한 기초 자료의 제공이 가능하다. 본 연구결과는 맥류 바이러스병 동시진단법으로서는 국내최초의 보고이며, 맥류 바이러스병 3종 동시진단키트는 농업현장에서 직접 활용이 가능하다.
대상 바이러스.
동시진단용 바이러스는 BaYMV, BaMMV, BYDV의 3종을 대상으로 하였다. 2014-2016년에 국내 보리 재배지로부터 위축, 황화, 줄무늬 등의 병징을 나타내는 바이러스 이병주를 채집하여 바이러스 감염을 확인하고 감염시료는 -70°C에 보관하면서 실험 재료로 사용하였다(Fig. 1).
RNA 추출 및 동시진단용 primer 제작
감염 시료잎을 액체질소를 사용하여 마쇄 후 RNeasy® Plant Mini Kit (QIAGEN, Germany)로 전체 RNA를 추출하고, Nano-Drop ND-1000 분광광도계(Thermo Scientific, Wilmington, USA)로 농도를 측정한 후 RT-PCR 진단의 주형으로 사용하였다. 3종 바이러스의 동시진단을 위한 primer는 BaYMV (GenBank D01091), BaMMV (GenBank L49381), BYDV (GenBank NC021481)의 외피단백질 유전자의 염기서열을 이용하여 제작하였다(Table 1).
동시진단 mRT-PCR
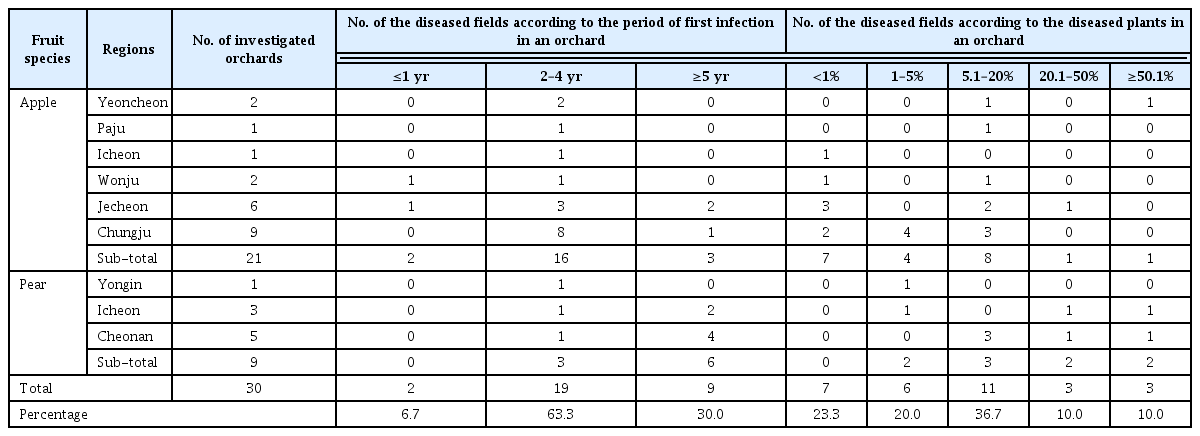
다중 RT-PCR (Multiplex RT-PCR, mRT-PCR)은 바이러스 감염주로부터 추출한 전체 RNA를 주형으로 하고 BaYMV, BaMMV, BYDV 3종 바이러스의 외피단백질 유전자에 특이적으로 반응하는 primer를 활용하여 수행되었다. mRT-PCR 반응은 AccessQuickTM RT-PCR System (Promega, USA)을 사용하여, 45°C에서 45분간 95°C 5분간, 1 cycle, 95°C 30초, 58°C 1분, 72°C 40초 35 cycle, 72°C 10분간 1 cycle 조건으로 수행하였다. 동시진단의 조건을 탐색하기 위하여 RNA 농도 및 primer 농도를 조절하면서 RT-PCR을 실시하였다. 증폭된 RT-PCR 산물은 1.5% agarose gel에서 전기영동으로 확인 하였다. 가장 특이적인 mRT-PCR의 조건을 설정하기 위하여 전체 RNA와 primer 농도를 조절한 결과 RNA 농도 BaMMV 800 ng/µl, BaYMV 800 ng/µl, BYDV 200 ng/µl에서 각 primer의 농도 BaMMV 10 pmol, BaYMV 15pmol, BYDV 5 pmol로 하였을 경우 BaMMV 595 bp, BaYMV 461 bp, BYDV 290 bp의 예상되는 크기에서 가장 명확한 밴드를 확인하였다(Fig. 2). 위의 조건으로 대상 바이러스의 단일, 2종, 3종에 대하여 RT-PCR 반응을 실시하고 단일, 2종의 바이러스에 대해서도 검정이 가능함을 확인하였다(Fig. 3). 본 실험으로 국내 맥류 주산단지를 중심으로 한 최근 3년간의 조사에서 발생이 확인된 BaYMV, BaMMV, BYDV 3종의 바이러스에 대한 동시진단법이 확립되었다. 동시진단방법은 기존의 각각의 바이러스에 대하여 단독으로 진단하는 RT-PCR과 비교하여 시간적, 경제적 절감효과가 보고되어 있다(cho 등, 2013).

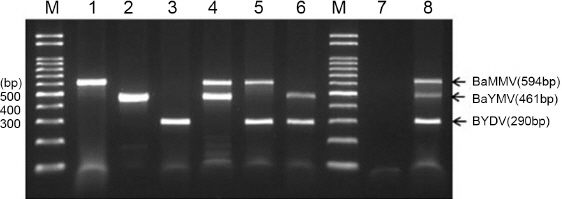
Testing the concentration of the primer. A set of virus specific primers of different concentration were carried out mRT-PCR with a 3 virus samples. Concentration of the total RNA is 800 ng/ml (BaMMV, BaYMV) and 200 ng/ml (BYDV). M: 100 bp size marker, Lane 1: BaMMV 10/BaYMV 10/BYDV 5 pmol, Lane 2: BaMMV 15/BaYMV 10/BYDV 5 pmol, Lane 3: BaMMV 10/BaYMV 15/BYDV 5 pmol, Lane 4: BaMMV 10/BaYMV 10/BYDV 5 pmol, Lane 5: BaMMV 15/BaYMV 10/BYDV 5 pmol, Lane 6: BaMMV 10/BaYMV 15/BYDV 5 pmol.
mRT-PCR 검정농도
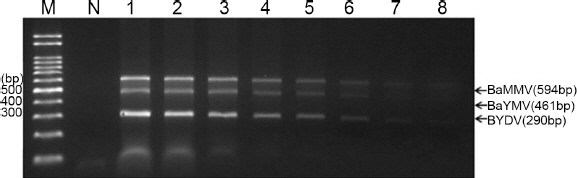
동시진단 RT-PCR의 검정농도의 한계를 확인하기 위하여 BaYMV, BaMMV, BYDV 3종류의 바이러스 혼합 RNA를 단계적으로 희석하여 mRT-PCR을 실시하였다. RNA 농도 500 ng/µl로 시작하여 2배씩 희석하여 RT-PCR을 실시한 결과 약 7.8 ng/µl에서도 반응이 확인되었다(Fig. 4). 이 결과는 각각의 바이러스를 희석하여 RT-PCR 한 결과와 차이가 없었다(data not shown). 단독으로 진단하는 것과 비교할 때 시간적, 경제적인 효과는 충분히 확인되는 결과이나, 본 실험에서는 바이러스 농도에 대한 민감성에 대해서도 7.8 ng/µl로 미량의 RNA 농도에서도 효과가 확인되었다. 다른 바이러스 mRT-PCR 검정농도는 약 0.5 ng-5 ng 정도로 바이러스에 따라 차이는 있는 것으로 보고되고 있다(Jarosová와 Kundu, 2010). 본 연구에서는 확립된 동시진단법을 활용한 진단키트를 제작하여 농업현장에서 직접 활용가능 할 것으로 판단된다.
요약
최근 국내 맥류 재배지에서는 대부분 BaMMV, BaYMV, BYDV의 발생이 확인되고 있다. 본 연구에서는 multiplex reverse transcription polymerse chain reaction (mRT-PCR) 방법에 의해 이들 3종류의 바이러스를 동시에 진단하는 방법을 확립하였다. 이들 3종 바이러스의 외피단백질 유전자 정보를 활용하여 각 바이러스에 대한 primer를 제작하였다. mRT-PCR에 사용한 primer는 RT-PCR 반응의 민감도와 특이성에 의해 선발하여 primer 농도와 mRT-PCR의 조건을 설정하였다. 각 바이러스에 대하여 선발된 primer 사용에 의한 mRT-PCR 결과 BaMMV 594 bp, BaYMV 461 bp, BYDV 290 bp의 PCR 산물을 얻을 수 있었다. 본 연구에서 확립된 맥류 바이러스 동시진단방법은 신속하고 특이적인 진단 뿐 아니라 맥류 바이러스병의 전염 등 역학 연구에도 활용 될 것으로 기대된다.
Acknowledgement
This research was supported by a grant from National Institute of Crop Science, Rural Development Administration, Republic of Korea (Project No. PJ01119402).
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.