Chlorella fusca를 전처리한 오이 잎에서 오이탄저병균의 초미세 감염구조 관찰
Ultra-structural Observations of Colletotrichum orbiculare on Cucumber Leaves Pre-treated with Chlorella fusca
Article information
Abstract
Chlorella is one of the microorganisms which can live autotrophically by their own photosynthesis. It was previously revealed that pre-treatment of Chlorella fusca caused a suppression of appressorium formation on the cucumber leaves after inoculation with Colletothrichum orbiculare. In this study, the ultrastructures of C. orbiculare on the cucumber leaves pretreated with C. fusca were observed using both scanning electron microscope (SEM) and transmission electron microscope (TEM). The SEM images revealed that most fungal conidia and hyphae were attached with lots of C. fusca cells. Also, the conidia could germinate but not form appressorium, which is necessary to penetrate into host tissue. These observations suggested that C. fusca adjoined to the fungus may play a role in suppression of the appressorium formation. On the other hand, the observations of TEM showed no remarkable cytological differences on the ultrastructures of the intracellular hyphae between in the pre-treated and untreated leaves. It seemed that the fungus could grow in the pre-treated plant tissues as in the untreated one. Based on these observations, it is suggested that the suppression of appressorium on the leaf surfaces by the C. fusca cells may be a main cause of the reduction of the anthracnose disease.
서론
오이탄저병의 원인균인 Colletotrichum orbiculare는 세계적으로 여러 종류의 작물에 감염하여 경제적 피해를 입힌다(Agrios, 2005). 벼 도열병균인 Magnaporthe oryzae와 마찬가지로 오이탄저병균은 식물에 침입하기 위하여 발아관 상단이 부풀어져 부착기(Appressorium)라는 특별한 기관을 형성한다. 식물 표면에 접한 부착기는 내부에 멜라닌 층이 형성되는데 이러한 멜라닌 층은 부착기 기능과 병원균의 병원력에 밀접한 관계가 있다고 알려져 있다(Chumley와 Valent, 1990). 즉, 멜라닌 층의 선택적 투과성으로 인하여 부착기 내부에 팽압이 증진되며 이는 부착기에서 유래한 침입균사가 식물 큐티클 층과 세포벽을 관통하는 데 기여한다(Bechinger 등, 1999; Howard와 Ferrari, 1989).
Colletotrichum에 속하는 병원균은 감염 시 두 가지의 영양섭취 방식을 취하는데(Perfect 등, 1999), 첫째, 볼록한 형태의 제1차 균사는 살아 있는 기주 식물의 표피 세포에서 활물영양단계를 거친다. 그 후 가느다란 제2차 균사는 비교적 빠르게 생장하며 엽육세포를 침입하여 사물영양단계로 접어들면서 기주 세포를 괴사시킨다(Bailey 등, 1996). 이러한 특이적 영양섭취방식을 취함으로 인하여 기주와 병원균과의 상호관계를 밝히는 많은 연구에 모델로 이용되어 왔다(Gan 등, 2013; Kubo 등, 2015; O’Connell 등, 2012).
Chlorella는 광합성을 통해 자가영양이 가능한 녹조류로서 이용가치가 매우 높은 것으로 알려져 있다. 지금까지 대부분 영양 공급원으로 이용되었는데, 최근 농업에서 생산량 증대의 원인이며 비료로 사용 가능성도 제기되었다(Safi 등, 2014; Shaaban, 2001). 그 외 식물 병해 감소에도 효과가 있는 것으로 보고되었는데 과채류의 저장성 병해에 대해 방제 효과가 있으며(Kim 등, 2014), 특히 오이 식물 잎에 전처리하였더니 오이탄저병의 발생이 억제되었다고 보고되었다(Lee 등, 2016).
그러나 Chlorella에 의한 식물 병 억제 기작에 대해서는 많이 알려져 있지 않다. 이전 연구에 의하면 Chlorella 일종인 C. fusca를 전처리한 오이 잎은 무처리한 잎에 비해 오이탄저병균을 접종한 후 부착기 형성률이 뚜렷하게 감소되는 것을 알 수 있었다(Lee 등, 2016). 따라서 이 결과를 통해 C. fusca 에 의한 식물 잎 표면에서 지금까지 알려져 있지 않은 생화학적 또는 구조적 작용으로 인한 오이탄저병균의 부착기 형성이 감소될 것이라고 추측되었고 부착기 형성 억제가 병 감소의 원인이라고 판단하였다. 그러나 광학형광현미경을 통한 관찰만으로는 병 억제 기작에 대한 설명이 충분하지 않다. 따라서 본 연구에서는 전사전자현미경을 이용하여 C. fusca를 전처리한 오이 잎에 오이탄저병균을 접종한 후 식물 표면에서 C. fusca와 오이탄저병균과의 관계를 보다 정밀하게 관찰하였다. 또한 투과전자현미경을 이용하여 식물조직에 침입한 오이탄저병균의 세포 외 균사 및 세포 내 균사 내부를 관찰함으로써 무처리한 식물조직 내에서의 오이탄저병균 균사와 비교함으로써 C. fusca에 의한 병 억제 원인을 좀 더 자세히 밝히고자 하였다.
재료 및 방법
식물체
오이종자는 정선삼척(Cucumis sativus L., cv. Jeongseonsamcheok; FarmHannong, Seoul, Korea) 품종으로 시중에서 구입하여 사용하였다. 오이 종자를 원예용 상토(Tuksimi®; Nongwoobio, Suwon, Korea)가 채워진 플라스틱 포트(직경 8 cm)에 파종하여 주간 25°C±1°C, 야간 18°C±1°C, 광주기 12:12가 유지되는 식물 배양실에서 배양하였다. 정식 10일 후, 제1엽이 완전히 전개된 식물을 실험재료로 사용하였다.
Chlorella
Chlorella fusca CHK0059 균주를 국립농업과학원으로부터 분양 받아 Kim 등(2014)이 제시한 BG11 modified medium (BGMM) 배지를 사용하여 배양하였다. C. fusca를 28°C에서 5일간 삼단분리법으로 배양한 후 단일 균총을 채취하여 5% BGMM 액체배지에 접종하였다. C. fusca의 광합성 수행을 위해 배양용기에 기포발생기(PD-40; Zhongshan Chuangxing Electrical Appliances, Zhongshan, China)를 설치한 후 28°C, 5,000 lux에서 7일간 배양하였다. 오이 식물에 처리하기 위한 C. fusca 현탁액의 세포수는 hemocytometer (Hausser Scientific, Horsham, PA, USA)를 이용하여 2.0X107 cells/ml로 조정하고 0.01% Tween 20을 첨가하여 오이식물 전처리에 사용하였다.
식물병원균 접종원
식물 병원균으로 탄저병에 감염된 오이 잎에서 분리한 오이탄저병균인 C. orbiculare를 이용하였다. 오이탄저병균을 감자한천배지(potato dextrose agar; Becton, Dickinson and Company, Le Pont-de-Claix, France)에 접종하여 25°C가 유지되는 항온기(DA-MIL-2500; Dong-A, Siheung, Korea)에서 10일간 배양하였다. 포자가 생성된 배지에 멸균수 10 ml를 첨가하여 포자를 수확한 후 포자현탁액 농도를 1.0X105 conidia/ml가 되도록 조절하여 0.01% Tween 20을 첨가한 후 접종원으로 사용하였다.
C. fusca 전처리와 오이탄저병균 접종
준비한 C. fusca 현탁액을 오이 식물체 1엽과 2엽에 충분히 젖을 정도로 분무한 후 상온에서 2시간 동안 건조시켰다. C. fusca의 오이탄저병 발생 억제 정도를 비교하기 위해 C. fusca 현탁액 대신 살균수와 시판 중인 살균제 benzimidazole (Benomyl®, a.i. 50%, WP; Agrotech, Seoul, Korea)을 관행농도로 동일한 방법으로 각각 분무 처리하였다. 처리된 식물 잎이 건조된 후 접종원인 오이탄저병균 현탁액을 완전히 젖을 정도로 분무 접종하였다. 접종된 오이식물체를 28°C, 99% 상대습도를 유지하는 항온항습기에서(DA-DC; Dong-A) 24시간 동안 보관한 후 주간 25°C±1°C, 야간 18°C±1°C가 유지되는 식물 배양실로 옮겨 배양하였다.
SEM 관찰을 위한 식물조직처리
주사전자현미경(scanning electron microscope, SEM)을 이용해 C. fusca에 의한 오이탄저병균의 감염 억제 양상을 관찰하기 위하여 살균수 및 C. fusca를 전처리하고 오이탄저병균을 접종한 잎을 1일, 3일, 5일 후에 각각 채취하였다. 시료는 처리당 6개 식물에서 각각 제1엽을 선택하였으며 채취한 잎에서 병반 부위를 면도날로 0.5X0.5 mm2의 크기로 잘라 2% glutaraldehyde를 포함한 0.05 M phosphate buffer solution (PBS)에 담아 30초 동안 진공 처리한 후 실온에서 2시간 동안 고정하였다. 고정이 끝난 시료를 PBS로 10분 동안 3회 세척하였다. 세척된 시료들은 ethanol 시리즈(30%, 50%, 70%, 80%, 90%, 95%, 100% 각각 10분)를 통해 탈수하였고, 100% acetone에 담아 30분 동안 2–3회 처리하여 치환하였다(Hayat, 1989).
각 시료들은 critical point dryer (CPD 030; Bal-tec, Los Angeles, CA, USA)로 임계점에서 15분 동안 건조시켰다. 건조된 시료들을 sputter coater-gold (108A sputter coater; Cressington Scientific Instruments, Watford, UK)로 표면을 금으로 코팅(~100 –)한 후 SEM (JSM-6700F; JEOL, Tokyo, Japan)을 통해 20 kV에서 처리당 제작한 6개 오이 잎 표면을 모두 관찰하였다.
투과전자현미경 관찰을 위한 식물조직처리
C. fusca를 처리한 식물체 내부에서의 오이탄저병균의 세포학적 형태를 무처리구와 비교하기 위하여 투과전자현미경(transmission electron microscope, TEM)을 이용하여 관찰하기 위해 살균수 및 C. fusca를 전처리하고 오이탄저병균을 접종한 잎을 3일, 5일 후에 채취하였고 시료 수는 SEM을 위한 전처리와 동일하게 수행하였다. 채취한 오이 잎의 감염 부위를 면도칼로 1X3 mm2로 자른 후 Jeun 등(2007)이 기술한 방법으로 고정, 탈수와 포매 과정을 수행하였다.
식물 시료를 2% glutaraldehyde를 포함한 0.05 M sodium cacodylate buffer solution (pH 7.2)으로 30초 동안 진공 처리한 후 4°C에서 2시간 동안 고정하였다. 1차 고정된 시료를 0.05 M sodium cacodylate buffer solution (pH 7.2)으로 10분 동안 3회 세척한 후 2% osmium tetroxide 용액에 담아 4°C에서 2시간 동안 2차로 고정한 후 살균된 증류수로 10분 동안 3회 세척하였다. 그 후 시료들은 ethanol 시리즈(30%, 50%, 70%, 80%, 90% 1회, 100% 3회 각각 10분)를 통해 탈수시키고 propylene oxide:Spurr resin을 2:1, 1:1, 1:2 비율과 100% Spurr resin을 각각 30분 동안 2회 치환시켰다. Spurr’s resin으로 치환된 시료를 70°C에서 12시간 동안 포매시킨 후 굳혀진 블록을 Ultramicrotome (MT-X; RMC, Tucson, AZ, USA)을 이용하여 초박절편(60–80 nm)을 작성하였다. 초박절편은 2% uranyl acetate와 lead citrate로 각각 2분 동안 염색한 후 TEM (JEM-1011; JEOL)을 통해 80 kV에서 처리당 제작한 6개 오이 잎 내부를 모두 관찰하였다.
결과 및 고찰
SEM을 이용한 오이탄저병균의 감염구조 관찰
오이 잎에 멸균수를 전처리하고 오이탄저병균를 접종한 후 오이식물 표면을 SEM으로 관찰한 결과 접종 12시간 후에 대부분 포자가 발아하여 발아관을 형성하였고 부착기는 대부분 관찰되지 않았다(Fig. 1A). 병원균을 접종한 후 1일째에는 대부분의 포자가 발아하였으며 발아된 포자에서 부착기가 자주 관찰되었다. 부착기의 모양은 구형이거나 곤봉모양으로 형성되어 있었다(Fig. 1B). 접종 후 3일째에는 병원균의 발아율과 부착기 형성률은 접종 후 1일째와 비슷하게 나타났으나 종종 함몰된 형태의 부착기가 관찰되었다(Fig. 1C). 이는 부착기 내의 세포질이 식물과 접촉한 부분에 형성된 침입균사를 통해 감염소포(infection vesicles)로 옮겨간 결과인 것으로 보인다(Perfect 등, 1999). 병원균 접종 후 5일째에는 함몰된 부착기가 더 자주 관찰되었으며(Fig. 1D) 부착기를 형성하지 못한 균사들은 길이생장을 지속하는 것으로 관찰되었다. 따라서 함몰된 부착기는 식물과 친화적 반응(compatible interaction)을 암시하지만 SEM을 이용한 관찰을 위한 인위적인 전처리를 통한 형태적 변화일 가능성도 배제할 수 없다(Pathan 등, 2008).
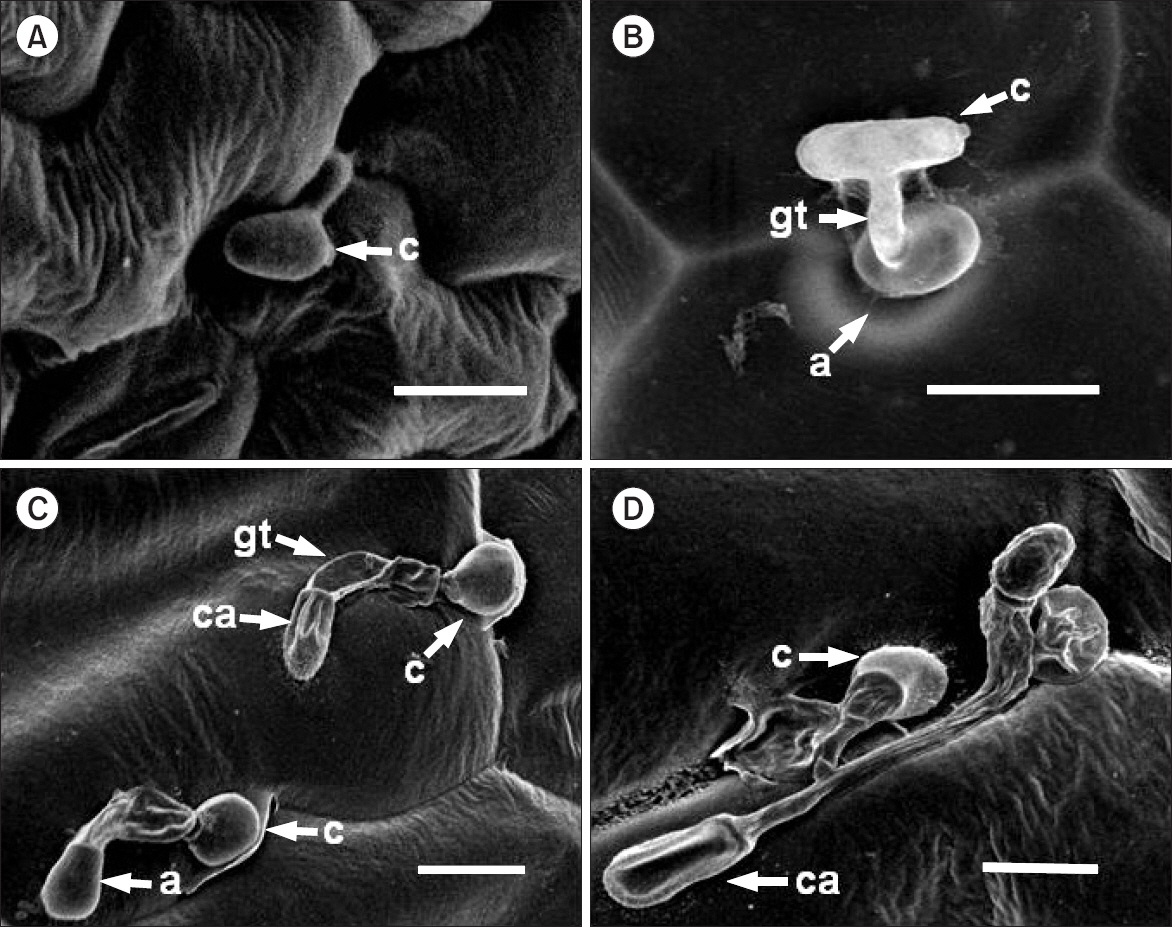
Photographs of scanning electron micrographs on the untreated cucumber leaves at 12 h (A), 1 day (B), 3 days (C), and 5 days (D) after inoculation with Colletotrichum orbiculare (1.0×105 conidia/ml). c, fungal conidia; gt, germ tube; a, appressorium; ca, collapsed appressorium. Scale bars=10 μm.
한편, C. fusca를 전처리한 오이 잎 표면에서 오이탄저병균을 접종한 후 SEM으로 관찰한 결과, 접종 12시간 후에 무처리구와 비슷하게 대부분의 포자가 발아하였으나 부착기는 관찰되지 않았다. 하지만 무처리구에서는 관찰할 수 없었던 C. fusca 세포들을 오이탄저병균의 포자 주변에서 관찰되었다(Fig. 2A). 접종 후 1일째에서는 병원균의 발아된 포자 주변에 C. fusca 세포들이 12시간에 비해 그 수가 증가되었다(Fig. 2B). 접종 후 3일째에는 분지된 오이탄저병균의 균사가 자주 관찰되었으며 병원균 균사와 접촉된 C. fusca 세포들이 많이 관찰되었다(Fig. 2C). 접종 후 5일째는 부착기가 형성되지 않은 오이탄저병균 균사의 길이생장이 무처리에 비해 왕성하였으며 그 주변에 C. fusca 세포의 증식도 뚜렷하게 관찰되었다(Fig. 2D).
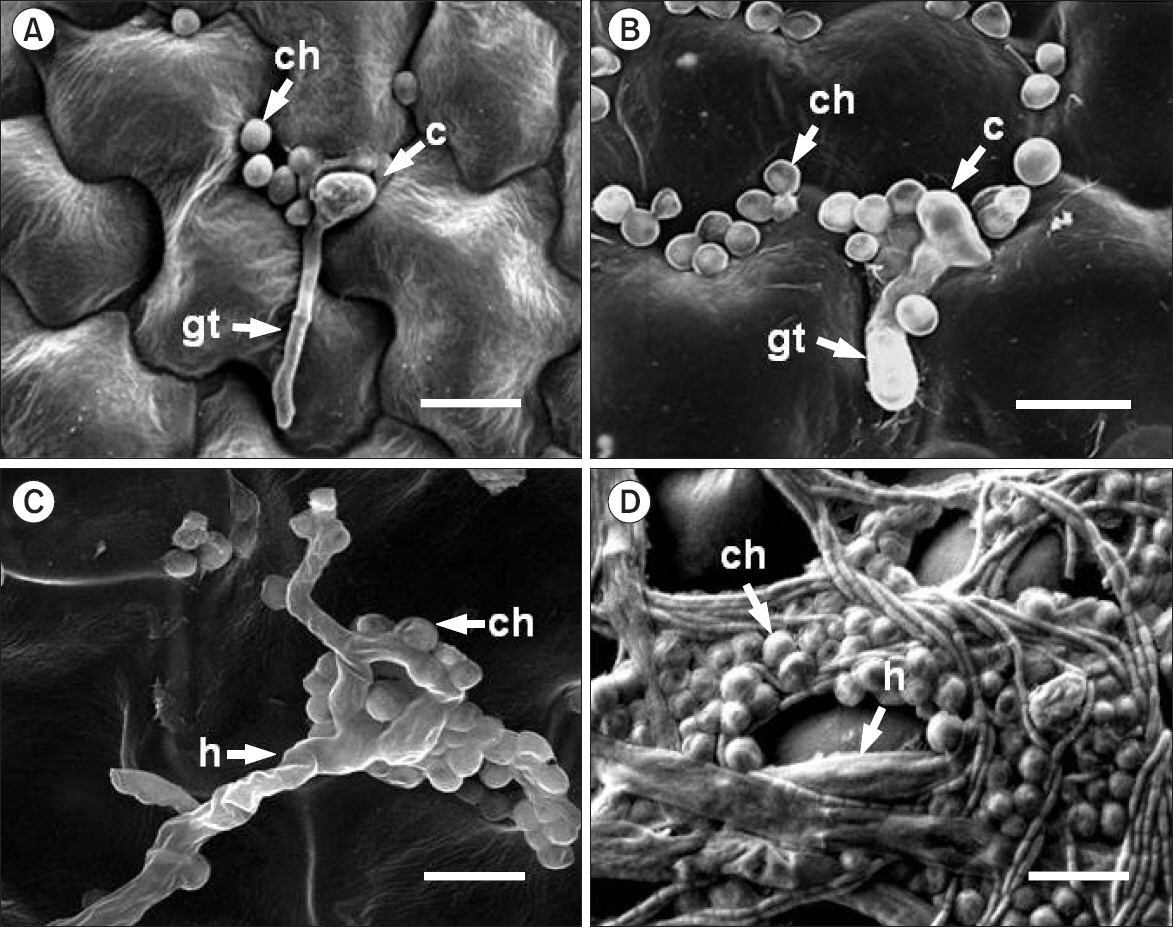
Photographs of scanning electron micrographs on the cucumber leaves pre-treated with Chlorella fusca (1.0×107 cells/ml) at 12 h (A), 1 day (B), 3 days (C), and 5 days (D) after inoculation with Colletotrichum orbiculare (1.0×105 conidia/ml). c, fungal conidia; ch, C. fusca; gt, germ tube; h, fungal hyphae. Scale bars=10 μm.
선행연구(Lee 등, 2016)에서 C. fusca를 전처리하고 오이탄저병균을 접종한 오이 잎을 형광현미경으로 관찰한 결과 무처리구에 비해 발아율에는 큰 차이가 없었으나 부착기 형성률이 C. fusca를 전처리한 오이 잎에서 뚜렷하게 감소하였다. 부착기 감소는 병 발생억제에 직접적인 원인이 될 수 있으므로 본 실험에서는 SEM을 통해 C. fusca에 의한 부착기 형성 억제 기작을 관찰하고자 하였다. 예상했던 대로 오이탄저병균 균사에 직접 접촉된 C. fusca 세포를 SEM을 통하여 관찰할 수 있었으며(Fig. 2C) 이는 병원균의 정상적인 성장을 저해하는 것이 아닌가 생각된다. 즉, C. fusca 세포가 오이탄저병균 균사에 접촉되어 오이탄저병균의 균사 생장에 영향을 주어 부착기 형성을 억제하는 원인이 될 수 있다고 판단된다. 다른 한편으로는 시간 경과에 따라 C. fusca 세포 수가 증가하는 것도 관찰되었는데(Fig. 2), 이를 통해 식물체에서 공간적 또는 영양적 경합이 일어나 오이탄저병균의 부착기 형성이 억제될 수 있는 가능성도 배제할 수 없다. 특히 Chlorella는 무성생식으로 증식하고 통상 10–30시간에 1회씩 4개의 낭세포로 분열하여 증식을 계속하므로 하루에 4–16배로 증식속도가 매우 빠르다고 알려져 있다(Kang 등, 2004; Safi 등, 2014). 실제로 길항세균 Pseudomonas pudia와 Burkholderia gladioli를 감귤 잎에 전처리하고 감귤더뎅이병을 접종했을 때 접종 부위에서 접종원의 밀도를 감소시킬 수 있다고 보고된 바 있다(Kim 등, 2011).
TEM을 이용한 오이탄저병균의 세포구조 관찰
무처리한 오이 식물에 오이탄저병균 접종 후 5일째 식물조직을 관찰하였더니 잎 전체 조직 즉, 표피세포 내, 세포간 공간 그리고 엽육세포 내에서 각각 발견되었다. 표피세포 내에서 발견된 세포 내 균사는 원형(intact)을 그대로 유지하고 있었다. 종종 오이탄저병균의 침입 후에 액포막이 손상된 듯 보이며 그로 인한 세포 내용 물질이 칩입균사 주위에서 관찰되었다(Fig. 3A; arrow). 마찬가지로 세포 간 공간에서 발견된 오이탄저병균 균사 내에서도 미토콘드리아와 같은 세포 기관이 원형대로 관찰되었다(Fig. 3B). 엽육세포 내에서 있는 오이탄저병균은 인접한 식물세포로 침입하였으며 침입 부위에 엽육세포의 원형질 세포막이 세포벽과 분리되는 장면이 가끔 관찰되었지만(Fig. 3C; arrow) 특별한 식물세포의 저항성 반응은 관찰되지 않았다. 이러한 활물영양단계에서는 많은 수의 오이탄저병균 1차 균사(primary hyphae)가 발견되었다(Fig. 3C). 사물영양단계를 거치는 오이탄저병균의 2차 균사(secondary hyphae)와 식물의 원형질막 사이에 기질(matrix)이 형성된 것이 종종 관찰되었으며(Fig. 3D; arrow) 많은 식물 세포가 급격히 사멸되었으나 원형을 유지하는 균사가 관찰되었다(data not shown).
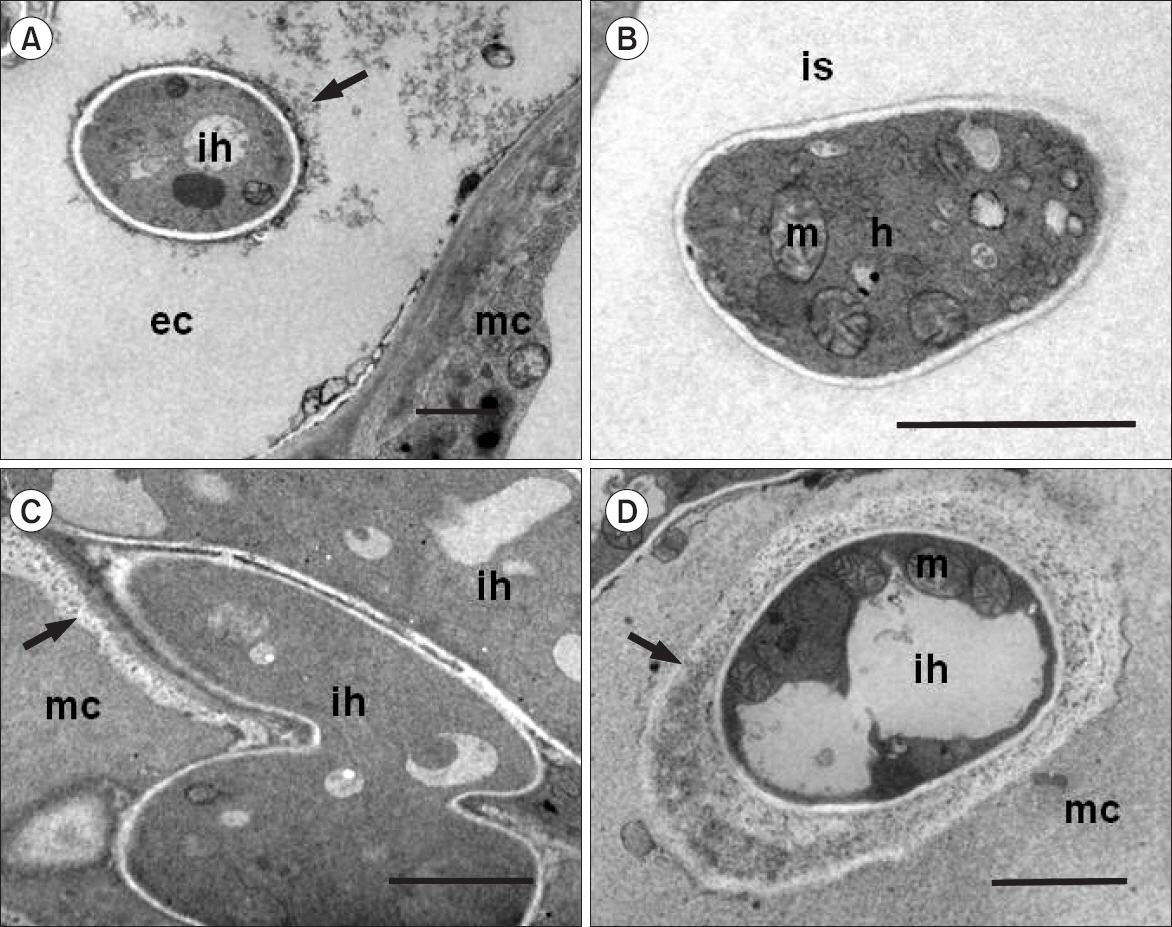
Photographs of transmission electron micrographs in the untreated cucumber leaves at 5 days after inoculation with Colletotrichum orbiculare (1.0×105 conidia/ml). The fungal hyphae were observed in the epidermal cell (A), intercellular space (B), and mesophyll cells (C, D) of the plant tissues. ih, intracellular hyphae; ec, epidermic cell; mc, mesophyll cell; is, intercellular space; m, mitochondria; h: intercellular hyphae. Scale bars=2 μm.
Chlorella를 전처리한 오이 식물에서도 발견된 오이탄저병균의 대부분이 무처리한 비교구 식물조직에서 관찰된 균사와 형태적으로 또한 세포학적으로 유사하였다. 식물의 표피 세포에서 발견된 오이탄저병균의 균사는 원형을 유지하였다(Fig. 4A). 병원균 침입으로 인한 엽육세포의 세포질에는 침입 균사 주변으로 소낭이 다수 발견되었으나(Fig. 4C; arrow) 세포 붕괴는 일어나지 않았다(Fig. 4A). 세포 간 공간에서의 세포 외 균사도 무처리 식물조직에서 발견된 것과 유사하며 미코콘드리아의 형태가 온전하였다(Fig. 4B). 식물의 방어 기작이 주로 나타나는 엽육세포에서도 뚜렷한 저항성 반응은 관찰되지 않았으며 이는 Chlorella 처리가 오이탄저병균의 식물 세포 내의 성장에는 별다른 영향을 미치지 못한다는 것을 의미한다. 다만 무처리 조직에서도 관찰되는 소낭이 침입 균사 주변에 종종 관찰되었다(Fig. 4C). 즉 1차 균사의 침입에는 뚜렷한 식물의 반응이 나타나지 않는 것으로 나타났다(Fig. 4C). 사물영양단계를 거치는 2차 균사 주위에는 무처리 식물조직에서와 마찬가지로 침입균사와 원형질 막 사이의 기질형성이 관찰되었으며(Fig. 4D; arrow) 병원균의 침입을 받은 식물세포 대부분이 형태를 알아보기 어렵을 정도로 사멸되었다(data not shown).
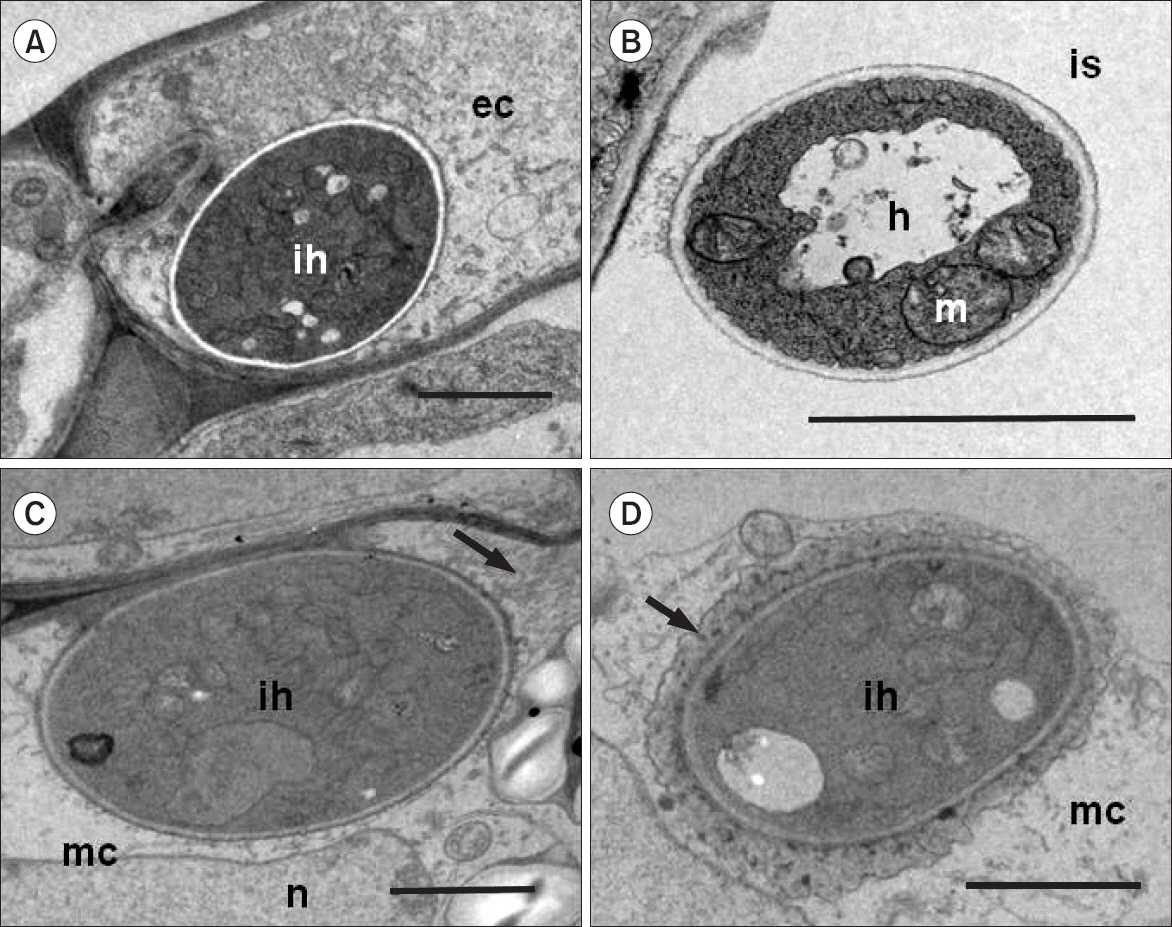
Photographs of transmission electron micrographs in the cucumber leaves pre-treated with Chlorella fusca at 5 days after inoculation with Colletotrichum orbiculare (1.0×105 conidia/ml). The fungal hyphae were observed in the epidermal cell (A), intercellular space (B), and mesophyll cells (C, D) of the plant tissues. ih, intracellular hyphae; ec, epidermic cell; h, intercellular hyphae; m, mitochondria; is, intercellular space; mc, mesophyll cell; n, nucleus. Scale bars=2 μm.
오이탄저병균은 다른 탄저병균과 마찬가지로 기주식물에 침입한 후 활물영양단계와 사물영양단계 과정을 거처 기주식물을 감염시킨다(Perfect 등, 1999). 본 연구에서도 무처리 식물에 오이탄저병균이 침입한 후 활물영양단계의 제1차 균사가 관찰되었으며 주위의 식물 세포들은 대부분 원형을 유지함으로써 활물영양 관계가 이루어지고 있음을 알 수 있었다(Fig. 3C). 사물영양 단계에서는 오이탄저병균의 2차 균사(secondary hyphae)와 식물의 원형질막 사이에 기질(matrix)이 형성되었는데, 이를 통해 식물의 대사산물이 병원균으로 흡수되는 것으로 추측된다(Fig. 3D). 하지만 이러한 기질을 통한 영양분 교환이 일어나는지를 입증하려면 면역학적 라벨링을 통한 연구가 수행되어야 한다.
이전 연구를 통해서 C. fusca를 전처리한 식물에서는 오이탄저병에 대한 감염률이 감소된다는 것을 입증하였다. 게다가 C. fusca를 전처리한 식물에서는 오이탄저병균이 부착기 형성 능력이 감소하였고 그 결과 감염률이 감소하는 것으로 판단되었다(Lee 등, 2016). 그러나 TEM을 이용한 관찰을 통해 C. fusca를 전처리한 식물에서의 오이탄저병균 성장이 무처리한 식물에서와 뚜렷한 차이를 발견하지 못하였다(Fig. 3, 4). 이를 통해 아마도 C. fusca를 전처리한 식물에서는 식물조직 내부에서보다는 부착기 형성 억제와 같은 감염 전에 병 발생 억제 기작을 통해 병 진전이 감소되는 것으로 판단된다.
요약
Chlorella는 광합성을 통해 자가영양하는 미생물이다. 이전 연구를 통해 Chlorella fusca를 전처리한 오이 잎에서 오이탄저병균의 부착기 형성률이 억제됨을 밝혔다. 본 연구에서는 SEM 및 TEM을 통해 C. fusca를 전처리한 잎에서 오이탄저병균의 초미세 감염구조를 관찰하였다. SEM 이미지에서는 대부분의 병원균 포자와 균사 주위에 많은 수의 C. fusca 세포가 관찰되었다. 또한 포자는 발아되었으나 식물조직에 침입하는 데 필요한 부착기는 형성되지 않았다. 이를 통하여 병원균 주위에 있는 C. fusca 세포가 병원균 부착기 형성을 억제하는 데 역할을 할 것으로 생각되었다. 한편, TEM 이미지를 통한 병원균 균사 내부의 초미세 구조에서는 C. fusca를 전처리한 잎과 무처리한 잎 간에 별다른 차이가 관찰되지 않았다. 이는 전처리한 식물에서 병원균은 무처리한 잎과 유사하게 성장하는 것으로 보인다. 이들 결과를 통하여 C. fusca에 의한 식물 표면에서의 병원균 부착기 형성 억제가 오이탄저병 감소의 원인인 것으로 판단된다.
Acknowledgements
We are thankful to Dr. Shim C.K., Organic Agriculture Division, National Academy of Agricultural Science, RDA, for supplying the Chlorella fusca strain. This work was carried out with the support of “cooperative research Program for Agriculture Science and Technology Development (Project No. PJ01170704)” Rural Development Administration, Republic of Korea.
References
Notes
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.