Pseudomonas capsici에 의한 아주까리 세균점무늬병의 국내 첫 보고
First Report of Bacterial Spot Disease Caused by Pseudomonas capsici on Castor Bean in Korea
Article information
Abstract
2021년 8월 부산광역시 강서구에서 아주까리의 잎과 줄기에 점무늬병의 발생이 확인되었다. 아주까리 분리균은 tryptic soy agar에서 점액성이 없고 연한 녹색을 띠는 둥근 콜로니를 형성하였다. 세균은 단극성으로 다수의 편모를 가진 막대 모양이었다. 세균을 건전한 아주까리 유묘에 접종했을 때, 동일한 점무늬 증상의 괴사 반응이 나타났다. 병징이 나타난 부위에서 세균을 재분리하여 동일균 여부를 확인하였다. 분리균은 감자 무름 반응과 D-fucose 대사반응이 양성이었으며, troleandomycin에서 생장할 수 있었다. 16S rRNA와 항존유전자(gyrB, rpoD) 염기서열의 상동성을 비교하였을때, Pseudomonas capsici와 유연관계가 가장 높았다. 결과적으로 아주까리에서 분리된 균은 배양적, 생화학적, 유전적 특성에 의해 P. capsici로 동정되었다. 본 연구는 국내 아주까리에서 P. capsici에 의한 점무늬병의 최초 보고이다.
Trans Abstract
In August 2021, water-soaking symptoms of bacterial spot disease were observed on castor bean in a field in Gangseo District, Busan. Bacteria isolated from the lesion when cultured on tryptic soy agar appeared to be nonmucoid and pale green. To confirm whether the isolates were the causative agent of the spot disease, they were inoculated onto healthy castor bean plants. The same symptoms were observed on the inoculated tissue, and the bacteria were reisolated from the lesion. Furthermore, the isolates were consistent with the biochemical and physiological features of Pseudomonas capsici. Sequencing analysis using 16S rRNA and housekeeping genes (gyrB, rpoD) showed that the isolates shared a high sequence similarity with P. capsici. These results confirmed that the strains belonged to P. capsici. To our knowledge, this is the first report of bacterial spot disease caused by P. capsici on castor bean in Korea.
아주까리(Ricinus communis L.)는 대극과에 속하는 다년생 식물이지만, 국내에서는 한해살이풀로 취급된다. 원산지는 동아프리카 내지는 인도로 추정되며, 남아메리카주와 아시아가 세계 총생산량의 80% 이상을 차지하고 있다. 온대 지방에서는 2–3 m까지 자라며, 줄기에 있는 20개 내외의 마디에서 긴 잎자루가 있는 잎이 어긋난다(Rana 등, 2012). 아주까리의 종자는 한약명으로 피마자라고 알려져 있다. 주로 약재와 기름으로 사용되는 유료작물이고 잎은 나물로도 이용된다(Patel 등, 2016). 세계적으로 아주까리에서 보고된 식물병은 Rhizoctonia solani 에 의한 모잘록병(Basseto 등, 2008)과 Cucumber mosaic virus에 의한 모자이크병(Raj 등, 2010) 등이 보고되었다. 국내에서는 Alternaria ricini에 의한 잎마름병 등 9종류의 진균병이 보고되었으나 세균병에 대한 보고는 없다(The Korean Society of Plant Pathology, 2022).
2021년 8월 부산광역시 강서구에서 아주까리의 잎과 줄기에 점무늬 증상이 발생한 것을 확인하였다. 수침상으로 갈색의 괴사된 점무늬 증상의 병징이 주로 잎에서 나타났고, 줄기에서도 세균병의 특징이 확인되었다(Fig. 1A, B). 본 연구에서는 아주까리에 점무늬 증상을 일으키는 세균을 분리하고 병원성을 검정하였다. 또한, 병원세균의 균학적 특성을 조사하고 16S rRNA 유전자와 항존유전자(gyrB, rpoD)의 염기서열을 분석한 결과, 분리균은 Pseudomonas capsici으로 동정되었다. 따라서, 본 연구를 통해 국내에서 발생한 P. capsici에 의한 아주까리 점무늬병을 새로운 병원균으로 보고하고자 한다.

Symptoms of bacterial spot disease on the leaves of castor bean in a field in Gangseo District, Busan (A, B). Pathogenicity of inoculates (YKB15539, YKB15540) on the leaves (C) and stem (D) of healthy castor bean. Colonies resulting from culture of samples from the lesions of on tryptic soy agar (E). Morphological characteristics of the castor bean isolates (F).
병징이 관찰된 식물체의 잎을 채집하여 병징으로부터 건전부위와 경계부위를 0.5×0.5 mm 크기로 자르고 70% 에탄올로 표면살균하였다. 멸균수를 700 μl 넣은 Pre-loaded Steel Bead Tube (taco Prep, Taipei, Taiwan)에 표면살균된 조직을 넣고 Prep Bead Beater (taco Prep)를 이용하여 13초간 마쇄하였다. 마쇄한 시료는 실온에서 30분간 정치한 후, tryptic soy agar (TSA; trpytone 15 g, soytone 5 g, NaCl 5 g, agar 15 g/l) 배지에 획선배양하여 28°C로 조절된 배양기에서 48시간 동안 배양하였다. 대표적인 세균의 콜로니를 선별하여 TSA 배지에서 같은 조건으로 4회 배양하여 단일 콜로니를 확보하였다. 순수 분리된 병원세균은 10% 글리세롤에 현탁하여 −80°C 냉동고에 동결 보존하여 실험에 사용하였다. 아주까리 잎의 병징에서 분리된 2개의 균주, YKB15539와 YKB15540의 병원성을 확인하기 위해 건전한 아주까리 유묘에 인공적으로 접종하였다. 접종원은 TSA 배지에 획선배양 후 28°C에서 48시간 자란 세균을 수거하고 멸균증류수에 현탁하여 2.0×106 cfu/ml로 농도를 조절하였다. 건전한 아주까리 유묘의 잎과 줄기에 주사기 침으로 상처를 내어 분리균을 접종하였으며, 대조군으로는 멸균수를 사용하였다. 모든 처리는 3반복으로 수행하였다. 접종 3-7일 경과 후 동일한 점무늬 병징의 발현 여부를 관찰하였으며(Fig. 1C, D), 발병된 부위에서 세균을 재분리하여 처음 접종한 균주와 균학적 특성 등을 비교하여 동일한 균주임을 확인하였다.
아주까리 분리균은 TSA 배지에서 점액성이 없었으며, 연한 녹색을 띠는 둥근 콜로니를 형성하였다(Fig. 1E). TSA 배지에서 28°C, 24시간 배양한 병원세균을 투과전자현미경(transmission electron microscopy, LEO 912 AB, Zeiss, Oberkochen, Germany)으로 형태를 관찰한 결과, 단극성으로 다수의 편모를 가진 막대 모양의 세균이었다(Fig. 1F). 분리균의 생화학적 특성을 조사하기 위해 LOPAT (levan 형성, oxidase 활성, 감자 무름 반응, alginine dihydrolase 활성, 담배 과민성반응) 검정을 수행하였다(Lelliott 등, 1966). 5% sucrose nutrient agar 배지에서 4일간 배양하여 levan 형성 여부를 조사하였으며, oxidase 활성 조사를 위해 nutrient glucose agar (beef extract 3 g, peptone 5 g, glucose 2.5 g, agar 15 g/l)에서 24시간 배양한 세균을 oxidase 활성 검사용 시약(bioMérieux, Craponne, France)에 처리하여 자주색 반응 여부를 파악하였다. 무름 반응의 조사를 위해 멸균된 칼로 표면 소독한 감자를 0.5 cm 두께로 절단한 뒤, 24시간 배양한 분리균을 절단면에 접종하였다. 접종 24시간 이후, 감자 무름 반응 여부를 조사하였다. 분리균을 arginine dihydrolase medium (peptone 1 g, NaCl 5 g, K2 HPO4 0.3 g, agar 3 g, phenol red 0.01 g, L-arginine HCl 10 g/l, pH 7.2)에 접종한 뒤 밀봉하였으며, 28°C에서 4일간 배양하였다. 배양 후 진한 분홍색의 변색을 조사하여 arginine dihydrolase 양성 여부를 파악하였다. 과민성 반응을 조사하기 위해 분리균을 1.0×107 cfu/ml 농도로 현탁하여 건전한 담배(cv. 삼선) 잎에 접종하였다. 접종 24시간 이후 과민성 반응 여부를 확인하였다. 추가적인 균학적 특성 조사를 위해 API 20 NE kit (bioMérieux)와 GEN III MicroPlate (Biolog, Hayward, CA, USA)를 이용하였으며, 세부적인 방법은 제조사의 권장 매뉴얼을 참조하였다. API 20 NE를 이용한 대사 반응 조사 결과, 분리균은 L-arabinose, capric acid, D-glucose, D-mannitol, malic acid, D-mannose, potassium gluconate와 trisodium citrate에서 양성 반응을 나타냈다. 반면, N-acetyl-glucosamine, adipic acid, D-maltose, phenylacetic acid는 음성으로 확인되었다. 아주까리 분리균은 Zhao 등(2021)이 보고한 P. capsici와 Trantas 등(2013)이 보고한 P. cichorii와 동일한 반응을 나타냈으며, Sarris 등(2012)이 보고한 P. viridiflava와는 capric acid, malic acid 반응에서 차이가 있는 것으로 확인되었다(Table 1). 따라서, 본 연구에서 분리된 균은 P. capsici 또는 P. cichorii로 추정되었다. LOPAT 검정 결과로 분리세균은 levan 형성 음성, oxidase 활성 양성, 감자 무름 반응 양성, arginine dihydrolase 활성 음성으로 나타났으며, 담배에서 과민성반응이 양성으로 확인되었다. 또한, GEN III microplate 검정을 통해 분리균이 α-D-glucose, D-mannose, D-fructose, D-galactose, D-fucose, inosine, D-mannitol, D-arabitol, myo-inositol, glycerol, D-aspartic acid, L-alanine, L-aspartic acid, L-glutamic acid, L-pyroglutamic acid, L-serine, D-gluconic acid, glucuronamaide, mucic acid, quinic acid, D-saccharic acid, methyl pyruvate, L-lactic acid, citric acid, α-keto-glutaric acid, D-malic acid, L-malic acid, γ-amino-butryric acid, propionic acid와 acetic acid를 물질대사에서 이용하는 것으로 확인되었고, 1% sodium lactate, fusidic acid, troleandomycin, rifamycin SV, lincomycin, guanidine HCl, niaproof 4, vancomycin, tetrazolium violet, tetrazolium blue, nalidixic acid, lithium chloride, potassium tellurite, aztreonam와 sodium bromate가 존재할 때도 생장이 가능한 것으로 나타났다(Table 2). 본 연구에서 분리된 아주까리 세균은 Zhao 등(2021)이 보고한 P. capsici의 생화학적 특성과 일치하였다. 그러나 Timilsina 등(2018)이 보고한 감자 무름 반응, D-fucose, troleandomycin 반응에서 P. cichorii와 차이가 났고, P. viridiflava와도 oxidase, D-sorbitol, troleandomycin 반응이 다르게 확인되었다. 결과적으로, 분리균이 P. capsici와 동일한 균학적 특성을 가진 것으로 확인되었다.
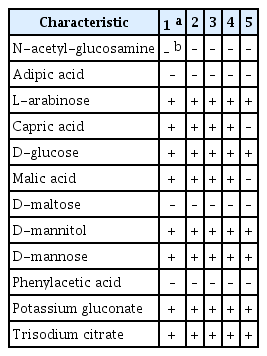
Distinguishing phenotypic characteristics between the isolated strains and representative strains of closely related Pseudomonas species
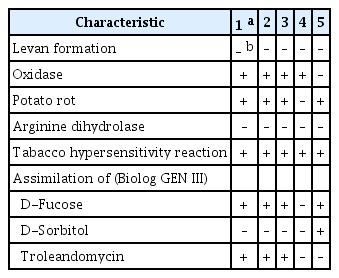
Biochemical profiling of isolated strains and other se-lected assimilation profiles in comparison to representative strains of closely related Pseudomonas species
16S rRNA 영역과 항존 유전자(gyrB, rpoD)의 염기서열 분석은 마크로젠(Macrogen, Daejeon, Korea)에 의뢰하였다. 분석된 염기서열은 National Center for Biotechnology In-formation (NCBI) GenBank에 등록되어있는 Pseudomonas 속의 유전자 정보를 참고하여 상동성을 비교하였다. 계통도는 MEGA X 프로그램을 사용하여 maximum likelihood 를 통해 작성하였으며(Guindon 등, 2010), 통계적 유의성은 1,000 반복의 bootstrap을 수행하여 확인하였다(Kumar 등, 2018). GenBank에 등록된 Pseudomonas속의 식물병원세균과 분리균(YKB15539, YKB15540)의 16S rRNA 영역의 염기서열과 계통학적 연관성을 비교한 결과, P. capsici Pc19-1 T과 같은 그룹(clade)으로 형성되는 것으로 확인되었다(Fig. 2A). 항존유전자(gyrB, rpoD)의 유연관계도에서도 P. capsici와 가장 높은 상동성을 나타냈다(Fig. 2B, C). 16S rRNA 영역과 항존유전자의 염기서열 분석 결과를 바탕으로 아주까리 분리균은 P. capsici로 확인되었다. 최종적으로, 분리세균은 병원성 검정, 균학적, 유전적 특성에 근거하여, P. capsici로 동정되었다. P. capsici의 경우 미국에서 고추(Cap-sicum annuum)의 잎에서 수침성 점무늬와 괴사를 일으키는 것으로 보고되었으나(Zhao 등, 2021), 국내에서는 보고된 바 없다. 따라서 국내 아주까리에서 P. capsici에 의한 점무늬병을 처음 보고하고자 한다.

Maximum-likelihood phylogenetic tree comparing the 16S rRNA (A), gyrB (B), and rpoD (C) sequences of the castor bean isolates and plant pathogenic Pseudomonas species. Nucleotide sequences of Pseudomonas spp. were retrieved from GenBank. Red arrows indicate the position of the sequences of the strains isolated in this study. All phylogenetic trees were constructed using 1,000 bootstrap replicates.
Notes
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.
Acknowledgments
This work was supported by the National Institute of Agricultural Sciences grant (PJ016734) from the Rural Development Administration, Republic of Korea.