수확 후 제주 당근 재배 토양에서 Xanthomonas hortorum pv. carotae 분리
Detection of Xanthomonas hortorum pv. carotae in Jeju Island Soils after Carrot Harvest
Article information
Abstract
당근 세균잎마름병은 세계적으로 가장 중요한 병에 속한다. 지난 10년 전 국내에서 처음 발견됨으로써 당근 생산에 큰 위협이 되는 병으로 간주되었다. 원인균으로 Xathomonas hortorum pv. carotae (Xhc)이며 본 연구는 제주도 당근재배지 토양에서 이 병원균을 분리 동정하고자 수행하였다. 분리한 세균 중 인공배지에서 균총의 형태가 당근 세균잎마름병균과 유사한 세균 균총을 분리하여 선발하였다. 또한 이들 선발된 세균들을 대상으로 DNA 염기 서열과 NCBI 자료를 통해 몇몇 분리 세균이 Xhc 으로 동정되었다. 게다가 이들 세균을 당근 잎에 접종하였더니 당근 세균잎마름병의 전형적인 병징이 나타났다. 본 연구 결과는 제주도 토양내 Xhc의 존재 가능성을 시사하고 앞으로의 당근 세균잎마름병 방제 수단을 강구하는 데 매우 필요한 자료로서 가치가 있다고 본다.
Trans Abstract
Bacterial leaf blight in carrot is one of the most important diseases in the worldwide. In the past decade, its introduction into Korea is causing great concern due to the potential damage to carrot crops domestically. This bacterial disease is caused by Xanthomonas hortorum pv. carotae (Xhc). This study aimed to isolate and identify bacterial strains from the soil of carrot farms in Jeju Island. The bacterial isolates showing characteristics similar with those of Xhc were selected when cultured on artificial media. Through DNA sequencing and analysis based on NCBI data, some of the selected bacterial strains were identified as Xhc. Furthermore, the bacterial strains caused the typical symptom of bacterial leaf blight after inoculation on carrot leaves. The results of this study showed the potential establishment of Xhc in the soil of Jeju Island and it may be valuable data for establish a strategy preventing the domestic spread of carrot bacterial leaf blight in the future.
전 세계적으로 경제 중요 10대 작물 중에 하나인 당근에 발생하는 당근 세균잎마름병은 Xanthomonas hortorum pv. carotae (Xhc)에 의해 발생하는 종자 전염성 세균병으로서 1931년 캘리포니아에서 처음 발견되었으며, 당근 종자 생산에 심한 피해를 줌으로써 당근 종자 수출에 막대한 지장을 초래하였고 결국 당근 생산량을 감소시켰다(Bastas 등, 2021; Kuan 등, 1985). 감염된 종자는 잎, 줄기 그리고 엽병에 작고 불규칙한 노란 반점을 일으키고 나중에는 수침상 병반과 괴저 증상으로 발전하며 당근 뿌리의 수확에 감소를 야기한다(Gilbertson, 2002).
주요 작물의 경제적 피해를 주는 당근 세균잎마름병은 미국의 여러 주뿐만 아니라 스페인에서도 발견되었으며(Gómez 등, 2021; Lee 등, 2013; Pfleger 등, 1974), 최근 일본과 대한민국의 제주도에서도 2012년에 처음 발견되었다(Du Toit 등, 2014; Myung 등, 2014; Nishiyama 등, 1979). 이러한 고위험성 식물병의 유입은 심각한 경제적 피해를 유발할 수도 있기 때문에 세계 각국에서는 철저한 국내외 검역을 통하여 식물병의 유입을 사전에 차단하려고 노력해왔다(Lee 등, 2013). 해외유입 병해충을 차단하지 못할 경우 국가적인 피해와 자국 농업생태계보호에 큰 영향을 줄 수 있기 때문에 당근 세균잎마름병은 해외유입 병해충의 일종으로 식물검역병해충에서 관리병균으로 구분되어 관리되어 왔다(Hong 등, 2020; Lee 등, 2013). 그러나 국제간 교류가 활발해지고, 농산물교역이 증가함에 따라 그 동안 보고되지 않았던 검역 대상 식물병원균이 국내로 유입되는 사례가 빈번하게 발생하였다(Hong 등, 2020).
우리나라 제주도에서 당근생산은 1980년대 이후 급속히 증가하였으며, 1993년 이후 전국의 50% 수준을 차지하는 등 제주도는 당근의 주요생산지로 역할을 하고 있다(Yoo와 Hyun, 1995). 그동안 당근 연구는 주로 재배 생리 등에 집중되었고 당근에 발생하는 병해충에 대한 연구는 본격적으로 이루어지지 않았지만 병해충의 국내 유입을 차단해야 한다는 요구가 꾸준히 제기되었다(Kwon 등, 2007). 당근 세균잎마름병 경우 국내로의 유입억제 노력에도 불구하고 2012년 제주도에서 조사 대상 50개 조사지 중 40%에서 Xhc가 발견되었으며, 평균 10%의 발병률을 보였다(Myung 등, 2014).
따라서 이미 국내로 유입된 당근 세균잎마름병 방제를 위하여 Xhc에 대한 국내 정착 여부를 조사하고, 위험성에 대한 종합적인 평가 및 선제적인 대응 체계의 구축이 필요하다. 기존 당근 세균잎마름병 연구는 종자와 식물체에 관한 연구가 주로 이루어졌다. 이에 비해 본 연구에서는 제주의 당근 재배 토양에서 Xhc의 생존 여부를 최초로 확인함으로써 재배환경 중 토양을 통한 전염 가능성을 제시하여 당근 세균잎마름병 확산 저지 수단을 수립하는 데 도움이 되는 자료를 제공하기 위해 수행하였다.
제주도 당근 재배 생산은 제주시 구좌, 성산, 표선 동부지역에 집단화 되어 있어(Yoo와 Hyun, 1995), 그 중 제주시 구좌읍을 중심으로 김녕리, 월정리, 덕천리, 행원리에서 당근 재배지인 16개 농가의 토양을 채취하였다(Fig. 1). 각 재배지에서는 당근 뿌리가 존재하였던 토양을 기준으로 15 cm 깊이에서 토양 50 g 을 채취하여 지퍼백에 넣은 후 사용하기 전까지 4°C 냉장고에 보관하였다. 채집한 토양 1 g을 살균수 10 ml에 넣어 토양 현탁액을 만들고 10배 희석하였다. 토양 희석액을 modified Kuzdas and Morse (MKM) (Hornsby 등, 2000) 배지에 100 μ l씩 루프를 이용하여 도말한 후 28°C에서 3일 동안 배양하였다.
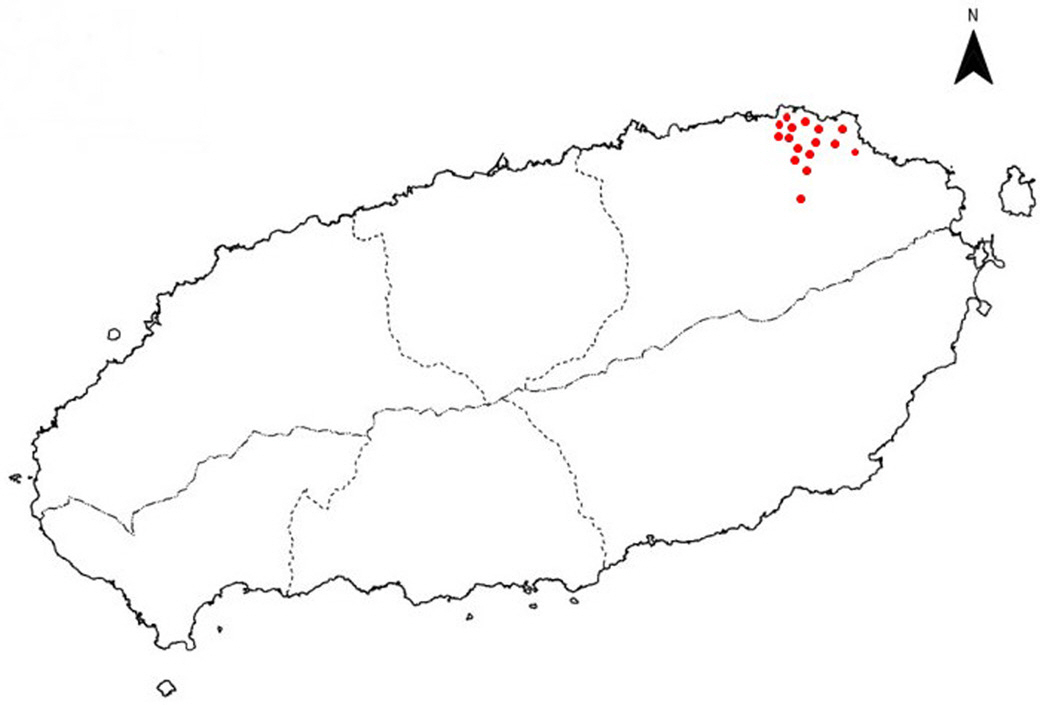
Location of carrot farms (red spots) isolated Xanthomonas hortorum pv. carotae in Jeju Island in this study.
MKM 배지에서 자란 분리균을 색, 크기 그리고 형태를 육안으로 관찰한 후 그 중 Xhc의 특성과 비슷한 형태를 보인 연노랑, 노랑 그리고 진노랑을 띄고 반짝이며 동그란 균총(International Seed Testing Association, 2014)을 선정하여 당근 세균잎마름병으로 육안 동정하였다(Fig. 2). 이들 세균을 삼단 분리 법으로 순수 분리한 후 30% glycerin이 포함된 tryptic soy broth (TSB; KisanBio Co., Ltd., Seoul, Korea) 배지에 옮긴 후 −80°C 초저온 냉동고에 보관하여 사용하였다.
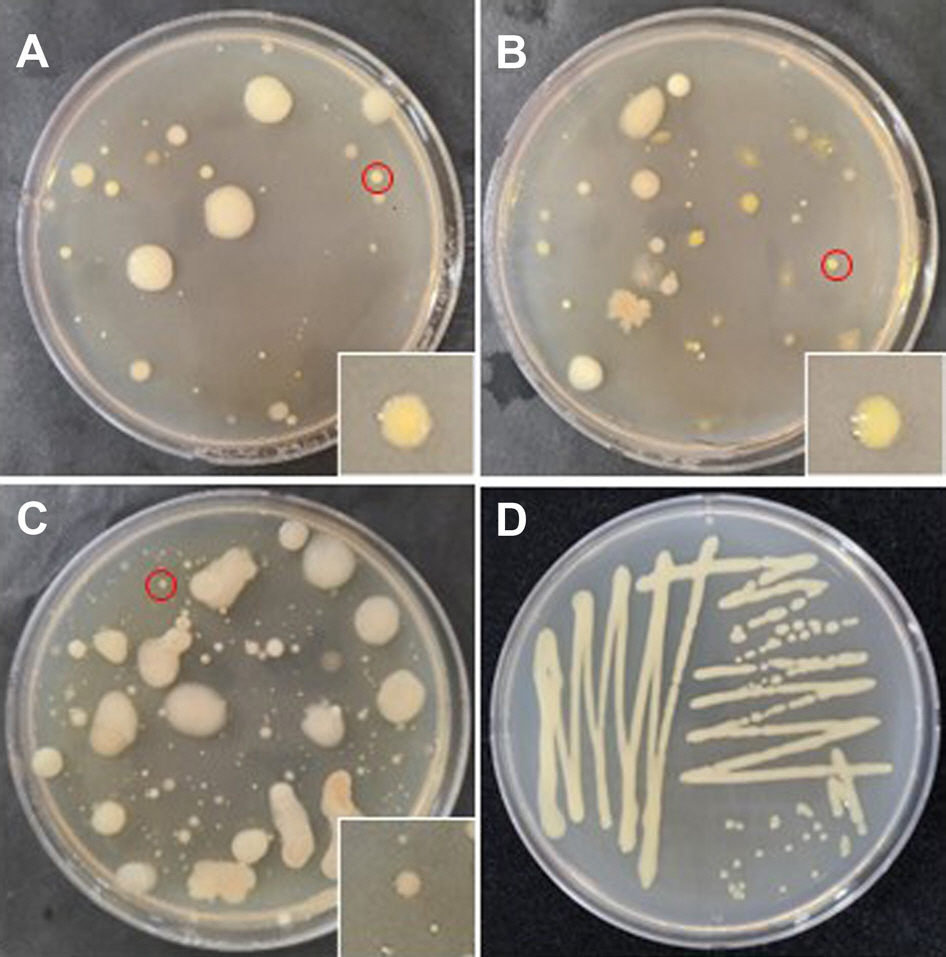
Bacterial colonies (A–C) and single colony by streaking (D) on modified Kuzdas and Morse medium from the carrot cultivating soil in Jeju Island. Red circles were selected as candidates for diagnosis by molecular biological analysis and the square boxes on right sides of each figure are magnified parts around red circles.
분리 세균의 total DNA 추출을 위해 보관된 균주 100 µl를 3 ml TSB에 첨가하여 28°C 진탕배양기(HB-201SL, HANBAEK Scientific Co., Bucheon, Korea)에서 80 rpm으로 3일 동안 진탕배양하였다. 진탕배양액 3 ml 중 2 ml를 2 ml 마이크로튜브로 옮겨 세균의 분자생물학적 동정을 위하여 DNeasy Plant Mini Kit (Qiagen, Venlo, Netherlands)를 이용하여 세균의 total DNA를 추출하였다.
기존의 표현형적 특성에 기반한 세균 동정은 세포의 형태와 균총의 색, 크기 등에서 공통적이고 특징적인 표현형에서 한 가지, 혹은 몇 가지 다른 특성을 포함하는 다른 종으로 동정하였다. 그러나 이러한 방법은 온도나 공기 조건 혹은 다양한 물질로 인해 다른 형태를 띄기도 해서 변별력 있는 표현형적인 특성을 찾아내기가 어려운 경우가 발생한다(Kim과 Jang, 2012). 따라서 본 연구에서는 육안으로 균총의 특성을 관찰한 후 정확한 동정을 위해 분리한 세균의 DNA 염기서열 분석을 통한 동정을 수행하였다.
분리한 세균은 Xhc에 특이적으로 350 bp 크기의 유전자를 증폭하는 프라이머를 사용하여 PCR 증폭하였다(Bastas 등, 2021; Meng 등, 2004). 각각 세균의 total DNA 2 µl, 각각의 primer 1 µl, 10× buffer 5 µl, dNTP 1 µl, MgCl2 5 µl, Taq polymerase (iNtRON BioTechnology Inc., Seoul, Korea) 0.25 µl에 나머지는 3차 증류수를 채워 total volume 50 µl로 cocktail 을 혼합하여 작성하였다. 작성된 PCR cocktail은 PCR Thermal Cycler Dice TP600 (TaKaRa, Tokyo, Japan)을 사용하여 95° C에서 5분 denature 후, 94° C에서 15초, 58° C에서 20초, 72° C에서 30초 동안 처리하여 총 35 cycle 반복 후 72° C에서 5분 동안 처리하여 해당 DNA를 증폭하였다(Bastas 등, 2021). 증폭된 DNA 는 1.2% agarose gel에서 전기영동을 통하여 DNA 증폭 유무를 확인하였다. 또한 증폭된 DNA sequence는 분석전문업체 Macrogen (Seoul, Korea)에 의뢰하여 분석하였고 분석된 자료는 National Center for Biotechnology Information (NCBI)의 홈페이지의 Basic Local Alignment Search Tool (BLAST; http://blast.ncbi.nlm.nih.gov/Blast.cgi)를 이용하여 등록되어 있는 세균의 염기서열과 비교하여 동정하였고 Molecular Evolutionary Genetics Analysis (version 11) software를 사용하여 선행 보고된 Xhc의 염기서열들과 계통학적 분석을 하였다.
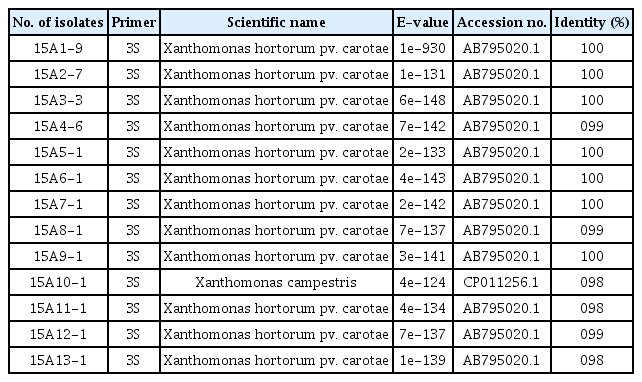
MKM 배지에서 균총의 형태가 육안상 Xhc와 유사한 균 중 임의로 13개 균총을 선정하여 그들의 DNA를 Xhc 특이적 primer 3S로 증폭한 결과 15A10-1 균주를 제외하고 모두 350 bp의 DNA절편이 증폭되었다(Fig. 3). 또한 비교구로 이용한 농촌진흥청에서 분양 받은 Xhc (JJ2001)의 동일 크기의 유전자가 증폭되었다. 이를 통해 15A10-1 균주를 제외한 12개 균주가 Xhc일 가능성이 높아, 선발된 균주의 보다 정확한 동정을 위해 증폭한 DNA 부분을 sequencing하여 NCBI를 통해 BLAST를 이용하여 분석하였더니 15A10-1 균주를 제외하고 12개 균주의 모두 Xhc로 동정되었고, 15A10-1 균주는 X. comperstris의 동정되었다(Table 1).
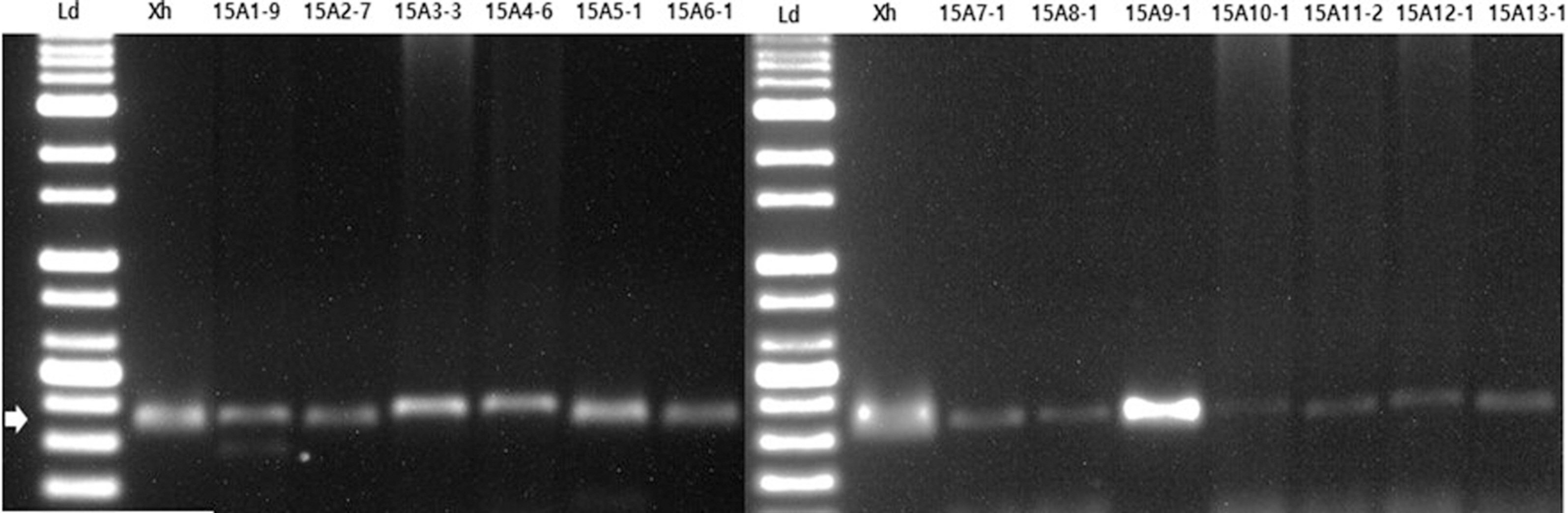
Gel electrophoresis images of polymerase chain reaction products of bacterial isolates from the carrot cultivating soil in Jeju Island using specific primer 3S (forward: 5′-CATTCCAAGAAGCAGCCA-3′, reverse: 5′-TCGCTCTTAACACCGTCA-3′). Ld, 1-kb DNA ladder (BIOFACT Co. Ltd.); Xh, Xanthomonas hortorum pv. carotae; lane 15A1-9–15A13-1, bacterial isolates from the carrot cultivation soil in Jeju Isalnd. Arrow indicates 350 bp.
Xhc로 동정된 세균의 보다 정확한 동정을 위해 코흐의 법칙에 의거하여 생체 접종 실험을 실시하였다. 생체 접종 실험을 위하여 당근종자(Dream7 품종)를 50°C 온수에서 20분간 온탕 소독한 후 파종하여 1엽이 완개한 당근 모종을 직경 10 cm 포트로 옮겨 심어 3–4엽이 전개된 당근 모종을 접종에 사용하였다.
분리 균주 중 15A9-1 균주를 TSA 배지에 도말하여 28°C에서 24시간 동안 배양한 후 멸균수를 이용하여 현탁액을 제조한 후 UV/VIS spectrophotometer (Optizen POP, Daejeon, Korea)를 이용하여 1.0×108 cfu/ml이 되도록 농도를 조정하였다. 접종원을 당근 식물체에 분무 접종한 후 상대습도 99%인 생장상(DA-DC, DONG-A, Siheung, Korea)에서 온도 28°C, 24시간 동안 보관한 후 온도 28±1°C, 습도 80–90%를 유지하는 식물배양실로 옮겨 병징이 나타날 때까지 배양하였다. 비교구로는 농촌진흥청에서 분양 받은 Xhc (JJ2001)를 사용하였으며 무처리구 비교구는 접종원 대신 H2 O를 분무하였다. 접종 후 25일 무처리구의 당근 잎에는 병반이 나타나지 않았지만(Fig. 4A) 15A9-1 균주를 접종한 잎과 분양 받은 Xhc 현탁액을 접종한 당근 잎에서는 당근 세균잎마름병의 전형적인 병징이 관찰되었다(Fig. 4B, C).

Carrot leaves H2 O-treated control (A), inoculating with Xanthomonas hortorum pv. carotae (Xhc) JJ2001 (B) and bacterial strain from the carrot cultivating soil in Jeju Island 15A9-1 (C) at 25 days after inoculation. Gel electrophoresis images of polymerase chain reaction products of bacterial isolates re-isolated from the artificial infected carrot leaves using specific primer 3S (forward: 5′-CATTCCAAGAAGCAGC-CA-3′, reverse: 5′-TCGCTCTTAACACCGTCA-3′) (D). Ld, 1-kb DNA ladder (BIOFACT Co. Ltd.); 1, Xhc JJ2001; 2, bacterial isolate 15A9-1. Arrow indicates 350 bp.
제주도 당근 재배 토양에서 분리한 세균 균주 15A9-1와 농촌진흥청에서 분양 받은 균주 Xhc (JJ2001)를 통한 인위적인 접종에 의해 감염된 당근 잎에서 발병부위를 5×5 mm2 크기로 절단하여 1% 차아염소산나트륨과 70% 알코올을 이용하여 표면 살균하였다. 살균된 식물조직을 멸균된 면도날을 이용하여 4등분으로 절단한 후 멸균수 1 ml를 넣고 10분간 vortexing한 후 상등액 100 μ l를 TSA 배지에 도말한 후 28°C에서 3일 동안 배양하였다. 배양한 세균의 total DNA를 토양에서 분리한 세균 균주에서와 동일한 방법으로 추출하였다. 또한 이들을 Xhc 특이적으로 프라이머 3S를 이용하여 PCR 증폭하였다. 증폭된 DNA 를 1.2% agarose gel에서 전기 영동하였더니 분리 균주 15A9-1와 분양 받은 균주 Xhc (JJ2001) 모두 350 bp에서 증폭됨을 확인하였다(Fig. 4D).
Xhc는 1931년 캘리포니아에서 Pseudomonas carotae라는 이름으로 발견되었다(Kendrick, 1934). 이후 1939년 새로운 분류체계를 제한하여, Pseudomonas속에서 노란색의 콜로니를 형성하는 균총을 Xanthomonas속이라는 이름으로 재분류하였다(Dawson, 1939). 박테리아 분류학에서 ‘ pathovar’라는 용어가 1978년에 만들어졌고, pv. carotae가 X. campestris 종으로 포함되었다(Young 등, 1978). Xantomonas comperstris pv. carotae는 1993년에 DNA-DNA 교잡(DNA-DNA hybridization) 연구 방법을 통해 최종적으로 X. hortorum종으로 구분되었다(Amann 등, 1995; Palleroni 등, 1993). 따라서 이러한 계통적 위치와 속명의 변화에 의해 Xhc와 X. comperstris 간의 유사성이 매우 높다고 할 수 있다(Dia 등, 2022; Dupas 등, 2023).
PCR 기법은 세균의 16S나 23S rRNA를 증폭하여 염기서열을 분석하는 데 이용하는 방법으로 분류 동정에서 흔히 쓰인다. 본 연구에서 인공 배지에서 형태적으로 Xhc와 유사한 특성을 나타내는 세균의 DNA 염기 서열을 분석한 결과 Xhc 뿐만 아니라 X. campestris로 동정되었다(Table 1). 이는 다른 연구에서도 Xhc로 식별된 대부분의 균주가 Xhc가 아닌 다른 종의 Xanthomonas으로 동정되는 경우가 보고되었다(Dupas 등, 2023; Morinière 등, 2020; Ritchie와 Dittapongpitch, 1991). 게다가 Xhc균주는 한동안 구분되어진 pathovar 외에도 이미 비병원성 균주를 군집화하는 것으로 알려진 X. abericola 및 X. campestris로 그룹화되어 있었다(Hong 등, 2020; Merda 등, 2017). 계통학적 분석 결과 조사한 균주는 2그룹으로 나뉘었고 제주 당근 토양에서 분리한 Xhc 13개 균주 모두 농촌진흥청에서 분양 받은 균주 Xhc JJ2001와 NCBI BLAST에 등록된 균주 중 하나인 Xhc 3S과 유전적으로 근연관계가 있는 것으로 나타났다(Fig. 5).

Phylogenetic tree analysis of Xanthomonas hortorum pv. carotae (Xhc) from the carrot cultivating soil in Jeju Island (15A1–15A13), strain Xhc JJ2001 from National Institute of Agricultural Sciences (arrow), strains registered in NCBI including strain.
Multilocus sequence analysis (MLSA)는 1998년부터 분류학적 목적을 위해 속과 종 간의 계통발생적 관계를 추론하는 방법으로 세균을 보다 정확한 동정을 하는 데 이용되고 있다(Koehler 등, 2003). MLSA 체계는 서로 다른 부분의 유전자 시퀀스 혹은 부분 유전자 집합 등을 기반으로 하여 연구 간의 다중적 비교를 한다. 실제로 Xhc로 동정된 결과 중 MLSA로 동정한 결과 그 중 한균주만 Xhc로 동정되었다(Catara 등, 2021). 본 연구에서는 비록 MLSA를 통한 동정을 실시하지 않았지만 Xhc 특이적 primer를 이용하여 증폭된 유전자 산물을 BLAST를 통한 동정이 이루어졌고 또한 코흐의 법칙에 의한 결과를 통해 분리한 세균이 Xhc로 동정된 것을 확인할 수 있었다.
따라서 제주도 당근재배지 토양에서 분리한 세균 중 국내검역대상 병이었던 당근 세균잎마름병을 일으키는 식물병원세균인 Xhc를 인공배지에서 균총의 형태적 동정 및 DNA염기 서열 분석을 통한 분자생물학적 동정으로 그 존재가 확인되었다. 본 연구 결과는 제주도 토양내 Xhc의 존재 가능성을 시사하고 앞으로의 당근 세균잎마름병 방제 수단을 강구하는 데 매우 필요한 자료로서 가치가 있다고 본다.
Notes
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.
Acknowledgments
This work was carried out with the support of “Cooperative Research Program for Agriculture Science & Technology Development (PJ0162412021)“ Rural Development Administration, Republic of Korea.