Septobasidium sp.에 의한 구실잣밤나무 고약병의 분자학적 다양성 분석
Analysis of Molecular Diversity in Castanopsis sieboldii with Felt Disease Caused by Septobasidium sp.
Article information
Abstract
2020년 제주도 동백동산 내 구실잣밤나무 수피에 고약병과 관련된 Septobasidium sp.가 발견되었다. 분리한 균주는 습실 처리하여 새로 생성된 균사에 대한 genomic DNA를 추출한 뒤 internal transcribed spacer 및 small subunit rDNA 유전자에 대해 염기서열을 밝혔으며 polymerase chain reaction-based restriction fragment length polymorphism 분석을 통해 균주들간의 분자학적 특성이 조사되었다. 이 새로운 Septobasidium sp.은 기존에 알려진 고약병들과 형태학적 및 계통학적으로 다르게 나타나 새로운 종으로 보고한다. 또한 이 고약병은 관찰 당시 주변의 다른 수목들에서는 발생하지 않고 오직 구실잣밤나무에서만 나타나는 특성으로 기주특이성이 매우 높다는 것이 확인되었다.
Trans Abstract
In 2020, within the Dongbaekdongsan area in Jeju Island, a Septobasidium sp. associated with a felt disease in Castanopsis sieboldii (Makino) Hatus. ex T. Yamaz. & Mashiba was identified. The symptom included the presence of brown, thin, and silk-like mycelial mats attached to the tree's bark, displaying variations in size from large to small. To induce hyphal growth, the samples collected were incubated in a moist chamber, and the newly formed hyphae were subjected to genomic DNA extractions. The nucleotide sequences of the internal transcribed spacer and small subunit rDNA genes were determined, and molecular characteristics among the isolates were investigated through polymerase chain reaction-based restriction fragment length polymorphism analysis. This Septobasidium sp. exhibited distinct morphological and phylogenetic features compared to those that were previously reported in South Korea. Consequently, this strain is taxonomically classified as a provisionally novel species of Septobasidium. Furthermore, the observed felt disease exhibited a high degree of host specificity, as it was exclusively identified in C. sieboldii without occurrence in other tree species at the time of observation.
상록 활엽 교목인 구실잣밤나무(Castanopsis sieboldii [Makino] Hatus. ex T. Yamaz. & Mashiba)는 주로 제주도, 완도등에 분포하고 국외에서는 중국, 타이완, 일본에 분포한다(Lee, 1998; Lee et al., 2009). 우리나라에 보고된 고약병 기주로는 Septobasidium bogoriense Pat.에 의한 매실나무 고약병, Septobasidium tanakae (Miyabe) Boedijn & B.A. Steinm. 에 의한 호두나무, 뽕나무, 서어나무, 졸참나무, 자두나무, 오동나무, 참다래, 사철나무, 벚나무, 밤나무, 매실나무 고약병이 보고되어 있고 최근에는 Septobasidium sp.에 의한 오미자, 감나무 고약병 등(Choi 등, 2016; Ha 등, 2021) 현재까지 활엽수 13종에서 고약병 발생이 보고되어 있다(Korean Society of Plant Pathology, 2022). 하지만 이 중에서도 오미자와 감나무에 대해서만 정식으로 보고되어 있어 여러 종류의 고약병에 관한 유전정보와 분자학적 다양성 정보는 부족한 실정이다. Septobasidium속은 처음 Patouillard (1892)에 의해 발견되었고, 이후 Couch (1938)와 Henk (2005)에 의해 200종이 넘게 분류되었다. Septobasidium 속들은 식물의 가지(잔가지), 줄기 및 잎에 붙어 자라고 많은 종류의 깍지벌레들(scale insects)이 이들의 균사막 안에서 기생하여 보호받고 있으며 병원균은 깍지벌레의 분비물을 섭취하여 증식하는 등 서로 공생관계에 있다(Couch, 1938). 2020년 7월 제주시 조천읍 동백동산 내 생육하는 구실잣밤나무들에서 원인을 알 수 없는 갈색의 얇은 비단모양의 균사체가 수피에 붙어있는 증상이 관찰되어 미관을 해치고 있었다. 구실잣밤나무 수피에 발생한 균사체를 관찰한 결과, 고동색 또는 짙은 갈색으로 나타났으며 감염목의 주간부에 둥근 타원형 모양의 크고 작은 균사체들이 5×9–13×32 cm 길이로 모여 자라 넓은 형태와 수피에 배착성으로 분포하였다. 균사체는 부드럽지 않고 표면이 거칠며 가장자리에는 새로운 균사들이 자라는데 처음에는 하얀색으로 발생하다가 성숙하면 점점 갈색으로 변하였다. 균사체는 기온이 낮은 2월에 갈색 또는 연한갈색으로 나타나다가 기온이 올라가는 7월에는 균사체 중앙부위부터 세로로 갈라지면서 균열이 생겼다(Fig. 1). 현미경 검경을 통해 균사를 관찰한 결과, 균사의 색깔은 갈색이며 균사층(hyphal mats)의 두께는 300–400 μm, 균사 크기는 1.5×2.0–5.5×7.0 μm로 측정되었다. 균사체 바깥쪽과 내부에는 가루깍지벌레류의 흔적도 관찰되었다. 구실잣밤나무 수피에서 발생한 균사체의 병원균 동정을 위해 예리한 칼로 수피 부분과 함께 잘라내어 균을 관찰하고 습실 처리하여 새로 나오는 균사를 사용하여 분자생물학적으로 동정하였다. 균사를 멸균된 칼로 분리하여 ZR Fungal/Bacterial DNA MiniPrep Kit (Zymo Research Co., Irvine, CA, USA) 매뉴얼대로 DNA를 추출하였다. 분리균의 internal transcribed spacer (ITS region), ITS 1, 5.8S, ITS2 유전자와 small subunit rDNA (SSU) 유전자 영역을 증폭하기 위해 각 유전자별 증폭 프라이머를 사용하였고(Table 1), Emerald-Amp GT PCR Master Mix (2× Pre-mix) (Takara Co., Tokyo, Japan)에 50−100 ng/μl 농도의 DNA를 넣고 각 유전자 영역별 양방향의 프라이머 10 pmole씩을 혼합한 뒤 멸균증류수로 최종산물을 25 μl 이 되게 하였다. 각 유전자 영역별 polymerase chain reaction (PCR) 반응은 94°C에서 5분간 denaturation, 96°C에서 30초간 denaturation, 이후 30초간 annealing하고(ITS1/ITS4: 55°C, NS1/NS6: 57°C), 72°C에서 1분간 extension을 30회 반복하였으며 최종적으로 72°C에서 10분간 extension을 하여 PCR을 마쳤다. 각 유전자 증폭 PCR 산물 6 μl와 Dyne Loading STAR (Dyne Bio Co., Seongnam, Korea) 1.2 μl를 혼합하여 1.3% agarose gel에서 100 V로 40분 전기영동을 하고 자외선 발산기를 사용하여 DNA 단일 band 증폭 여부를 확인하였다. 그 결과, 구실잣밤나무에서 발생한 균사체 JJsep-CS01, -CS02, -CS03에 대한 ITS rDNA and partials SSU rDNA의 각 유전자별로 동일한 범위의 밴드가 증폭되었다(Fig. 2). 또한 ITS rDNA 유전자 증폭 산물과 제한효소 Alu I과 Hap II 등을 사용한 polymerase chain reaction-based restriction fragment length polymorphism (PCR-RFLP) 분석 결과, 세 균주 모두 동일한 밴드 절편을 나타내어 분석한 시료들은 모두 동일한 계통으로 나타났고(Fig. 2), 각 유전자 영역별로 제한효소에 의해 절단된 밴드 패턴들은 추후 다른 기주에서 발생한 고약병들과 분자학적 다양성을 비교할 수 있을 것으로 판단된다. 각 유전자 영역에 대한 염기서열 분석결과 JJsep-CS01, -CS02, -CS03 고약병 균주의 ITS 유전자와 SSU rDNA 유전자 영역에서는 균주 간 서로 변이는 없었고, 분석된 염기서열은 교정 후 NCBI GenBank에 등록하였다(ITS 유전자 영역[OR898810−OR898812], SSU 유전자 영역 [OR898816−OR898818]). 한편, ITS rDNA과 partials SSU rDNA 유전자영역 염기서열을 National Center for Biotechnology information (NCBI)상 Septobasidium속 균주들과 분석한 결과, ITS rDNA 유전자에 영역에서는 uncultured Septobasidiaceae (MH005887) 균주와 93.3%의 상동성을 가져 가장 가까운 유연관계를 나타냈다(Xing 등, 2019). 우리나라에 보고되어 있는 오미자, 감나무 고약병 균주들과는 89.1%의 상동성을 가지고 S. bogoriense (HM209414)과는 87.1%의 상동성을 나타내어 같은 계통으로 나타나지 않았다(Choi 등, 2016; Ha 등, 2021). 오미자 및 감나무 고약병 균주들과 S. bogoriense (HM209414)도 서로 92.5%의 상동성을 가져 같은 계통으로 구분되지 않았다. SSU rDNA 유전자 영역 분석 결과, S. burtii (AY123322)와 98.1%의 상동성을 나타내었고 S. canescens (AY123320)과는 97.1%의 상동성을 보였으며(Kumar 등, 2007), Helicobasidium mompa 와도 96.9%의 상동성을 보였다(U77064). 하지만 S. taxodii (DQ241430), S. pseudopedicellatum (DQ241424), S. meredithiae (DQ241429), 그리고 S. alni (DQ241405)과는 상관관계를 갖지 않아 같은 Septobasidium속 내에서도 구분할 수 없었다(Henk 와 Vilgalys, 2007). 즉, 구실잣밤나무에서 분리한 균주 JJsep-CS01, -CS02, -CS03의 ITS rDNA 유전자는 NCBI GenBank 내 어떠한 Septobasidium속 내 균주들과도 같은 계통에 속하지 않은 것으로 확인되었고, SSU rDNA 유전자 분류에서는 녹균강(Pucciniomycetes) 내에서 분류가 불가능했으며 추가적인 연구가 필요한 것으로 판단되었다(Fig. 3). 현재까지 약 200종 이상의 고약병이 보고되었지만(Couch, 1938; Gomez와 Henk, 2004) 대부분 ITS 유전자 영역의 염기서열 분석과 유전적 다양성도 비교할 수 있는 PCR-RFLP 분석도 이루어지지 않아 분자학적 검정으로는 구실잣밤나무에서 분리한 Septobasidium의 정확한 동정이 불가능하였다. 이번 연구에서 구실잣밤나무에 발생한 고약병 균주는 중국에서 보고된 S. kameii의 균사층 두께(900–2,000 μm)와(Lu와 Guo, 2009) 국내 오미자 고약병에서 보고된 균사층 두께(500–800 μm)보다(Choi 등, 2016) 현저히 낮은 두께인 300–400 μm로 확인되었고 균사체의 색깔 등 외부형태적으로 다른 것으로 확인되었다. 또한 국내에서 발생한 오미자 및 감나무 고약병 균주들과 유전적으로도 같은 종으로 분류되지 않았다. 따라서, 본 연구에서 조사한 고약병은 우리나라에서 새로운 종류의 Septobasidium sp.에 의해 발생하는 것으로 밝혀졌고 이는 국내에서는 처음으로 구실잣밤나무에 발생한 고약병 보고이다.

Felt disease on Castanopsis sieboldii trees caused by Septobasidium sp. (A–C) Basidiomata on bark. (D) Molting of the scale insect. (E) Hyphae of basidiomata. Appearance of felt disease in February (F) and July (G).
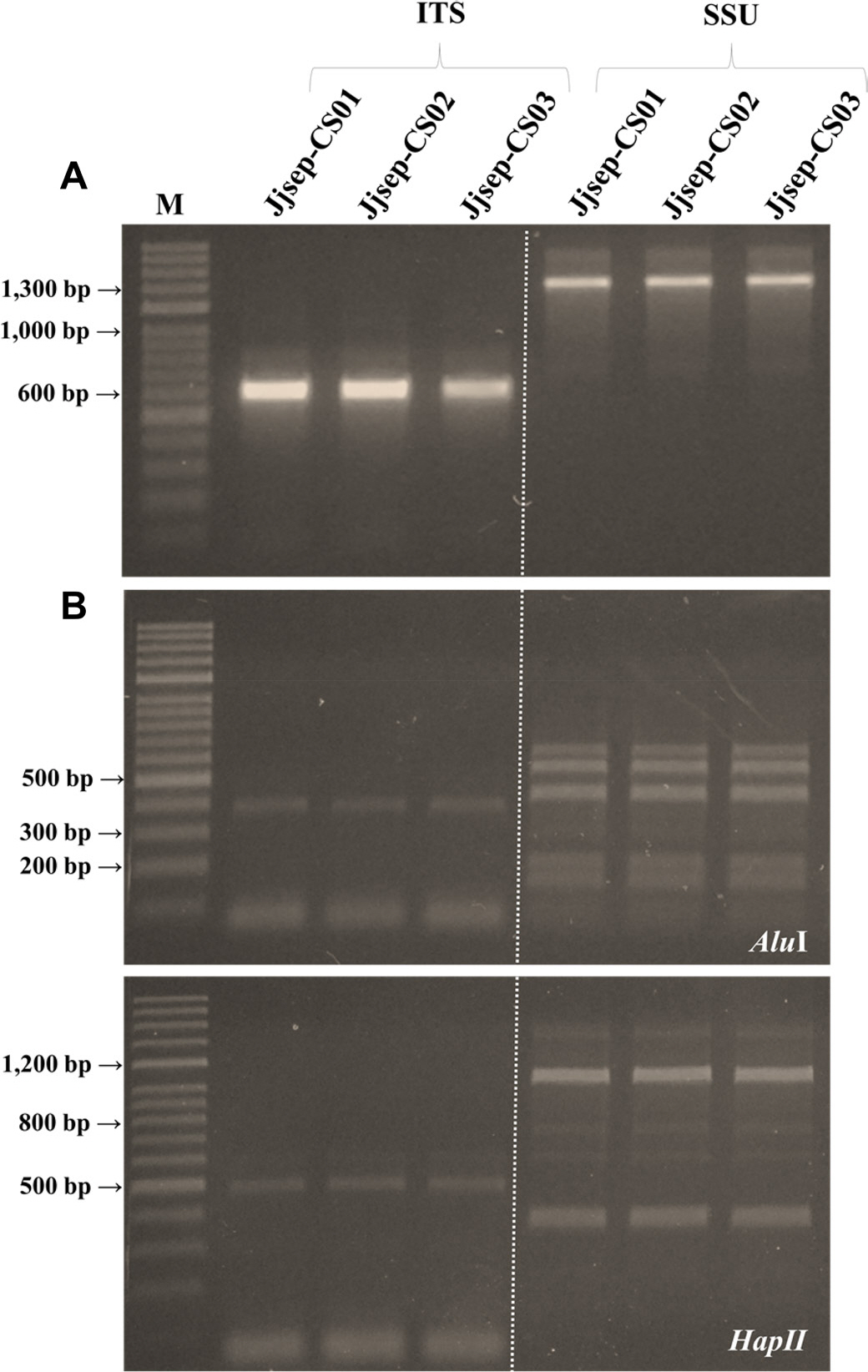
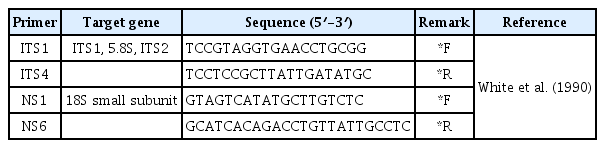
Analysis results of polymerase chain reaction (PCR) and restriction fragment length polymorphism (RFLP) profiles using internal transcribed spacer (ITS) and small subunit (SSU) rDNA re-gions for Septobasidium sp. of Castanopsis sieboldii felt disease. (A) PCR results of ITS and SSU rDNA. (B) PCR-RFLP profiles based on ITS rDNA using Alu I and Hap II enzymes.
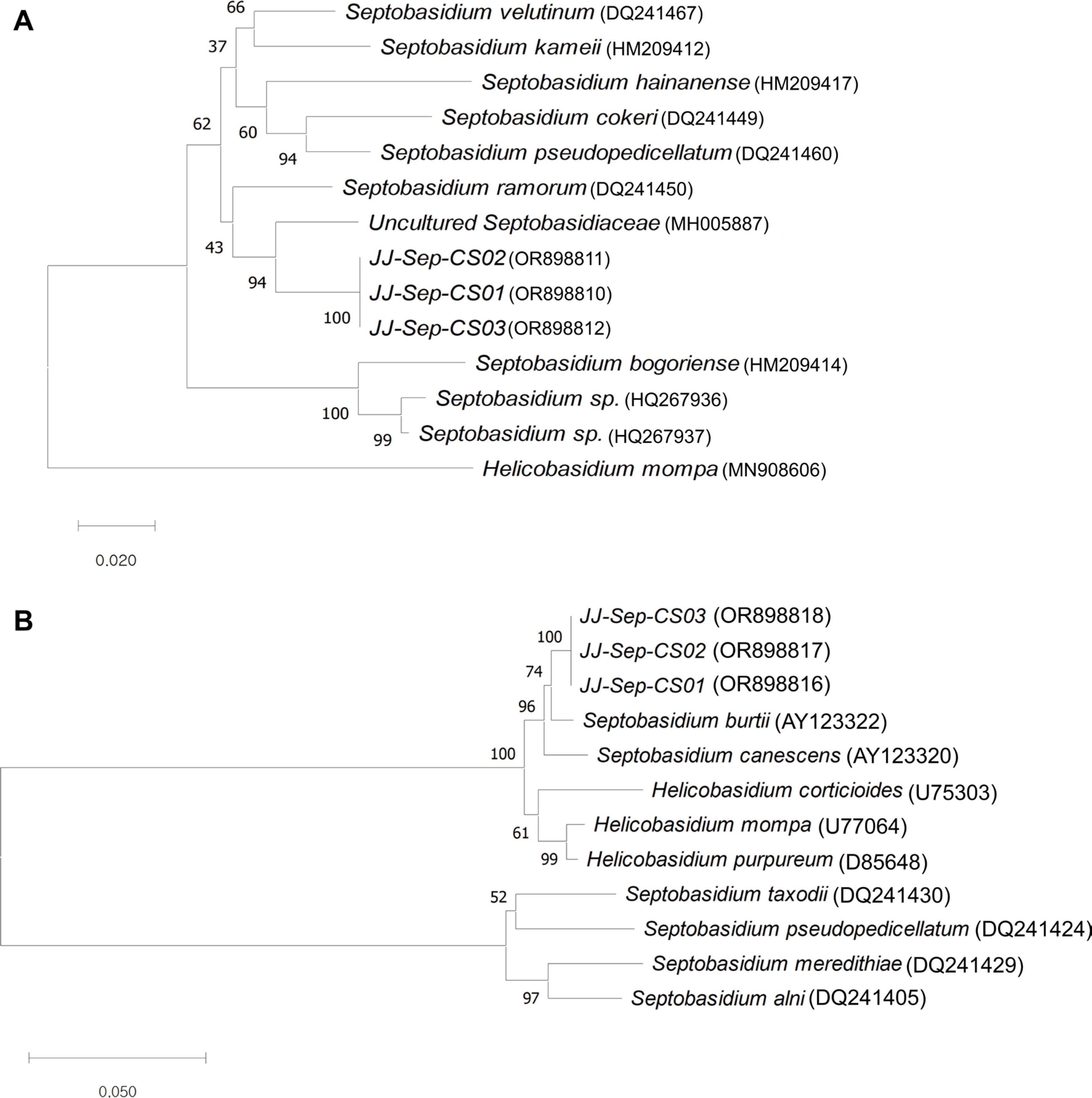
Phylogenetic relationship of Septobasidium by alignments of nucleotide sequences from the internal transcribed spacer (ITS) (A) and small subunit (SSU) rDNAs (B) performed with MEGA 11.0 software using the neighbor-joining method with the default values and 10,000 replications for bootstrap analysis.
Notes
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.
Acknolwledgments
This work was supported by the research grant of the Chungbuk National University.