Bacillus spp.를 이용한 사과 겹무늬썩음병의 생물학적 방제
Biological Control of White Rot in Apple Using Bacillus spp.
Article information
Abstract
본 연구에서는 사과 겹무늬썩음병을 유발하는 Botryosphaeria dothidea를 억제하는 길항미생물을 선발하였고, 선발한 길항미생물의 항균 활성과 길항 효소 생성 여부를 확인하였다. 선발된 길항미생물 중 4종은 Bacillus velezensis로 동정되었고, 1종은 B. amyloliquefaciens로 동정되었으며 이 길항미생물은 모두 겹무늬썩음병균에 강한 항균 활성을 가지고 있었다. 또한 선발된 5종의 길항미생물은 탄저병균인 Colletotrichum fructicola, 줄기마름병인 Diaporthe eres도 효과적으로 균사생장을 억제하였다. 선발된 길항미생물을 대상으로 cellulase, protease, phosphate solubilization 효소 활성을 분석한 결과 모두 효소를 분비하여 병원균의 생장을 억제 및 사멸시키고 식물 생장촉진 활성을 가지는 것으로 확인되었다. 사과 과실에서 겹무늬썩음병균과 선발된 길항미생물을 동시 접종하여 발병 억제 효과를 검정한 결과 B. velezensis 23-168 균주가 가장 효과적으로 발병을 억제하였다. 따라서 선발된 5종의 길항미생물은 사과 진균 방제를 위한 기초자료로 사용할 수 있을 것으로 생각된다.
Trans Abstract
Apple white rot, caused by Botryosphaeria dothidea, is one of the important diseases in Korea. B. dothidea can cause pre- and postharvest decay on apple fruit as well as canker and dieback of apple trees. In this study, we isolated bacteria from the trunk of apple trees and tested their antagonistic activity against B. dothidea. Five bacterial isolates (23-168, 23-169, 23-170, 23-172, and 23-173) were selected that were most effective at inhibiting the mycelial growth of the pathogens. The isolate 23-172 was identified as Bacillus amyloliquefaciens and four isolates 23-168, 23-169, 23-170, and 23-173 were identified as Bacillus velezensis by RNA polymerase beta subunit (rpoB) and DNA gyraseA subunit (gyrA) gene sequencing. All isolates showed strong antagonistic activity against B. dothidiea as well as Colletotrichum fructicola and Diaporthe eres. All isolates exhibited cellulolytic, proteolytic and phosphate solubilizing activities. In particular, two isolates 23-168, 23-169 were shown to significantly reduce the size of white rot lesions in pretreated apple fruits. These results will provide the basis for the development of a fungicide alternative for the control of white rot of apple.
서 론
국내 사과 재배면적은 34,359 ha로 과실 중 가장 넓은 재배 면적을 차지하고 있다. 주산단지인 경북과 충북에서 국내 사과 생산의 약 70%를 차지하고 있으나 기후온난화 영향으로 재배지역이 점차 북상하여 강원지역의 재배 면적이 점차 증가하고 있는 추세이다(Park 등, 2019).
한국식물병명목록에 따르면 우리나라 사과에는 49종의 병해가 발생 보고되어 있으며, 이 중 과실에서는 탄저병, 겹무늬썩음병, 잎에서는 점무늬낙엽병, 갈색무늬병, 가지와 줄기에서는 겹무늬썩음병, 부란병이 사과원에서 경제적 피해를 주는 주요 병해이다(Cheon과 Jeon, 2015).
Botryosphaeria dothidea에 의한 겹무늬썩음병은 7월 하, 순부터 과실에 발병하기 시작하여 수확 및 저장 중에도 과실을 부패시키고 나무 줄기에 기생하여 사마귀 또는 궤양 증상을 나타내며 줄기를 썩게 한다(Fig. 1). 우리나라는 1980년대 이후 후지 품종의 재배 면적이 증가하면서 겹무늬썩음병이 주요 문제 병해가 되었으며 특히 1998년 겹무늬썩음병이 대발생하여 농가에 큰 피해를 입혔다(Kim, 2002). 이후 사과 방제체계 프로그램이 개발되면서 겹무늬썩음병 발생이 감소하였으나 연간 평균 16회 이상의 살균제 살포 중 절반은 겹무늬썩음병 방제를 위해 살포할 것을 권장하고 있음에도 불구하고 산발적으로 발생하여 피해를 주고 있다(Kim 등, 1996).

Symptoms of apple caused by Botryosphaeria dothidea. (A, B) Stem canker and dieback. (C) Colony morphology of B. dothidea cultured on potato dextrose agar media for 5 days. (D) Conidial morphology of B. dothidea. Scale bar=20 μm.
줄기 병반에서 형성된 자낭포자와 분생포자는 대개 6–8월에 포자를 형성시켜 과실을 감염시키는 1차 전염원이 되는데 이 시기는 우리나라 장마철이므로 강우 지속으로 인한 약제 살포 지연은 겹무늬썩음병 대발생을 일으킬 수 있다(Jeong 등, 1994; Sutton과 Boyne, 1983). 또한 사과 겹무늬썩음병은 병원균의 감염 가능 기간과 잠복기간이 길어 방제가 어렵고 사과 수확 후에는 약제 살포를 할 수 없기 때문에 병원균을 억제할 수 있는 약제 대체 방제제가 필요하다(Lee 등, 2006a).
최근 살균제를 비롯한 화학 약제 오남용으로 살균제 저항성균 유발 가능성이 대두되고 있고, 화학 약제의 대체 및 보조제로 생물농약이 제시되고 있다(McManus, 2014). 사과 병해의 친환경적 방제를 위해 선발된 길항미생물은 Bacillus subtilis, B. amyloliquefaciens, B. halotelerans, B. atrophaeus, Pseudomonas syringae 등 보고되어 있다(Fan 등, 2017; Mu 등, 2020; Park과 Cho, 1996; Sun 등, 2023; Yin 등, 2011; Yuan 등, 2023). Bacillus spp.는 생물학적 방제제로 가장 많이 이용되고 있는 미생물로 독성물질 생산, 양분 경쟁, 기주식물의 저항성 유도 등의 다양한 방법으로 식물 병 방제가 가능하다(Chowdhury 등, 2015; Guo 등, 2014; Niu 등, 2013).
본 연구에서는 사과의 줄기에서 다수의 미생물을 분리하고 이들 중 B. dothidea에 길항하는 미생물을 선발하여 항균 활성과 생물검정을 통해 사과 겹무늬썩음병균의 생물학적 방제 가능성을 검토하였다.
재료 및 방법
길항미생물 및 병원균 분리.
길항미생물을 분리하기 위해 2023년 4월 전남 장성, 곡성의 사과 과원에서 건전한 나무의 지제부 줄기 조각을 채취하였다. 절취한 줄기 조각은 5 mm 정도의 크기로 잘라 표면 살균하여 Luria-Bertani (LB) agar 배지에 치상하였고, 25°C에서 2일간 배양하였다. 치상한 조직에서 발생한 균총의 형태와 색, 크기에 따라 육안검정하여 서로 다른 미생물을 새로운 LB 배지에 24시간 동안 배양하였고, 배양 이후 단일 콜로니를 분리하여 순수분리하였다. 분리한 균주들은 각각 20% glycerol에 현탁하여 −75°C deep freezer에 보관하여 사용하였다.
본 연구에 사용한 사과 겹무늬썩음병균은 길항미생물을 분리한 사과 과원의 줄기에서 사마귀 또는 궤양 조직을 절취하여 분리하였다(Fig. 1). 절취한 줄기 조각을 5 mm 정도의 크기로 잘라 표면 살균하여 potato dextrose agar (PDA) 배지에 치상하였고, 25°C에서 3일간 배양하였다. 치상한 조직에서 발생한 균사를 멸균한 팁을 이용하여 새로운 배지에 접종하였고, 25°C 에서 3일간 배양하여 단균사 분리하여 실험에 사용하였다. 분리한 균주는 20% glycerol로 포자 현탁액을 만들어 −75°C deep freezer에 보관하였다. 그 외의 사과 탄저병균인 Colletotrichum fructicola 23-287 (GenBank accession no. OR793854)과 줄기마름병균인 Diaporthe eres 23-281 (GenBank accession no. OR793853)은 국립원예특작과학원 원예특작환경과에서 보존 중인 것을 사용하였다.
DNA 추출, polymerase chain reaction 및 균주 동정.
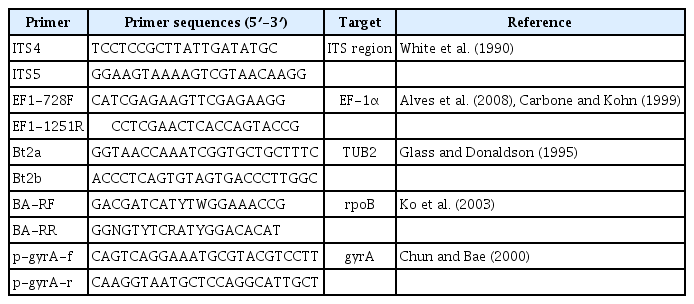
DNA 추출을 위해 분리한 겹무늬썩음병원균 B. dothidea 23-280은 PDA 배지에 접종하여 5일간 균을 배양하였고, 길항미생물은 LB broth 배지에 접종하여 28°C, 150 rpm으로 16시간 동안 진탕 배양시켰다. 이후 HiGene Genomic DNA Prep Kit (Biofact, Daejeon, Korea)의 방법에 따라 겹무늬썩음병원균과 길항미생물의 DNA를 추출하였다. 겹무늬썩음병원균의 동정을 위하여 internal transcribed spacer (ITS) region과, translation elongation factor 1α (EF-1α)와 β-tubulin (TUB2) 유전자를 각각 ITS4/5, EF1-728F/EF1-1251R, Bt2a/Bt2b primer를 사용하여 polymerase chain reaction (PCR)하였고(Alves 등, 2008; Carbone과 Kohn, 1999; Glass와 Donaldson, 1995; White 등, 1990), 길항미생물을 동정하기 위하여 RNA polymerase beta subunit (rpoB)와 DNA gyrase A subunit (gyrA) 유전자를 각각 BA-RF/BA-RR과 p-gyrA-f/p-gyrA-r primer를 사용하여 PCR하였다(Chun과 Bae, 2000; Ko 등, 2003). PCR에 사용된 primer 서열은 Table 1에 정리하였다. 증폭된 산물은 1% agarose gel에 전기영동하여 밴드를 확인하였으며, 확인된 밴드를 ExoSAP-IT (Thermo Fisher, Waltham, MA, USA)로 정제한 후 염기서열 분석 서비스를 이용하여 염기서열을 분석하였다(Biofact). 확인된 염기서열은 NCBI (http://www.ncbi.nlm.nih.gov/)의 BLASTN 프로그램을 사용하여 상동성을 비교 검색하였다. 검색된 염기서열은 MEGA 6의 ClusterW로 정렬하였고, maximum-likelihood 방법을 사용하여 1,000 bootstrap으로 phylogenetic tree를 만드는 데 사용하였다(Tamura 등, 2011; Thompson 등, 1997).
균사생장 억제효과 검정.
길항미생물의 겹무늬썩음병원균 균사생장 억제효과 검정을 위해 B. dothidea 23-280을 PDA 배지에 접종하여 25°C에서 3일간 배양하였고, cork borer를 사용하여 균총 선단부를 잘라내어 LPA (LB 50%+PDA 50%) 배지의 중앙에 접종하였다. 이후 cork borer 를 사용하여 주변부 3곳에 구멍을 내었고, LB broth 배지에서 16시간 동안 진탕 배양한 뒤 O.D값 1.0으로 조정한 길항미생물을 10 μ l씩 구멍에 접종하였다. 접종 후 25°C에서 2일간 배양한 뒤 아래와 같이 균사생장 억제율을 측정하여 길항미생물의 균사생장 억제효과를 검정하였다. 사과 줄기마름병균 D. eres 23-281와 사과 탄저병균 C. fructicola 23-287은 길항미생물의 항균 활성 범위를 알아보기 위해 사용하였으며, 접종 후 25°C에서 4일간 배양한 뒤 균사 생장 억제율을 측정하였다. 실험은 3반복으로 3차례 진행하였으며, 통계분석은 Duncan multiple range test를 사용하였다. 균사생장 억제율은 (1-처리구의 평균 균총의 직경/무처리구의 평균 균총의 직경)×100의 계산식에 의해 계산하였다.
효소활성 분석.
Cellulase 활성은 Sazci 등(1986)의 방법에 따라 carboxymethyl cellulose (CMC) agar 배지를 만들어 확인하였다. Cork borer를 사용하여 CMC agar 배지 중앙에 직경 5 mm 크기의 구멍을 만들었고, 그 안에 O.D 값 1.0으로 맞춘 10 μ l의 길항미생물을 접종하였다. 접종 후 25°C에서 12일간 배양한 뒤 0.1% Congo red 용액에 15분간 염색하였고, 1 M NaCl 용액에서 탈색시켜 clear zone의 형성을 확인하였다. Protease 활성은 Sokol 등(1979)의 방법에 따라 3% skim milk agar 배지를 만들어 확인하였다. 만든 배지에 cork borer를 사용하여 중앙부에 구멍을 만들고, O.D값 1.0의 길항미생물 10 μ l를 접종한 뒤, 25°C에서 20시간 동안 배양한 뒤 clear zone의 형성을 확인하였다. Phosphate solubilization (불용성 인산 가용화) 활성은 Nautiyal (1999)의 방법에 따라 Pikovskaya agar 배지를 만들어 확인하였다. 위와 같은 방법으로 Cork borer로 구멍을 뚫어 길항미생물을 접종하였으며, 25°C에서 14일간 배양한 뒤 접종 부 주변의 clear zone 형성 유무로 불용산 인산 가용 활성을 검정하였다.
사과 과실에서의 방제효과 검정.
길항미생물의 겹무늬썩음병 방제 효과를 알아보기 위해 사과의 과실을 사용하였다. LB broth 배지에서 16시간 동안 진탕 배양한 길항미생물을 O.D값 1.0으로 조정하였고, 길항미생물 현탁액 30 ml을 사과 과실 표면에 스프레이 처리한 후 PDA 배지에서 3일간 배양한 B. dothidea 23-280의 균총 선단부를 Cork borer로 잘라내어 길항미생물이 처리된 사과 표면에 접종하였다. 길항미생물과 겹무늬썩음병균이 접종된 사과를 플라스틱 상자에서 3일간 습실 처리하였고 접종 7일 후 병반의 직경을 측정하여 병 발생 억제율을 계산하였다. 실험은 3반복으로 3차례 진행하였으며, 병 발생 억제율은 (무처리구의 평균 병반의 직경-처리구의 평균 병반의 직경)/무처리구의 평균 병반의 직경×100의 계산식에 의해 계산하였다.
결과 및 고찰
겹무늬썩음병균과 길항미생물의 분리 및 동정.
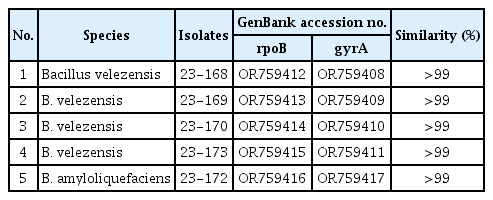
전남 장성과 곡성에 위치한 사과 포장에서 사과 주간부와 토양 시료를 채취하여 미생물을 분리하였다. 분리된 겹무늬썩음병균 23-280의 ITS, EF-1α, TUB2 유전자 염기서열 분석을 통한 phylogenetic tree 결과 B. dothidea로 분류, 동정되었다(Supplementary Table 1, Supplementary Fig. 1). 겹무늬썩음병균에 항균활성을 갖는 미생물을 선발하기 위해 B. dothidea 23-280와 분리된 미생물을 대치배양을 하였고, 강한 항균력을 보이는 5균주(23-168, 23-169, 23-170, 23-172, 23-173)를 선발하였다.
항균 활성을 보인 5균주의 게놈 DNA를 추출하여 gyrA, rpoB 유전자의 염기서열 분석을 통한 계통분류 및 동정을 진행하였다. 분석된 phylogenetic tree에서 23-168, 23-169, 23-170, 23-173은 B. velezensis로, 23-172는 B. amyloliquefaeciens로 분류, 동정되었다(Table 2, Fig. 2). Bacillus spp.는 다양한 항생물질을 생산하고 내생포자를 형성하기 때문에 식물 병 방제를 위한 생물학적 방제제로 연구되고 상업적으로 이용되고 있다. Bacillus subtilis species complex에 속하는 B. velezensis와 B. amyloliquefaciens는 서열이 매우 유사하여 이전에는 B. velzensis가 B. amyloliquefaciens로 분류되었지만 최근에는 항균 효과를 갖는 다양한 물질의 생성 차이 등에 의해 B. velzensis로 재분류되었다(Dunlap 등, 2016; Zaid 등, 2022). B. velezensis와 B. amyloliquefaciens는 bacillaene, iturin, Bacillomycin D, surfactin 등 항생물질을 분비하는 것으로 알려져 있다(Kang 등, 2017; Zaid 등, 2022). 이로 인해 Ralstonia solanacearum, Agrobacterium tumefaciens, Clavibacter michiganensis, Xanthomonas camp-estris, Alternaria brassicicola, Sclerotinia sclerotioum, Cylindro-carpon destructans를 포함한 주요 식물 병원성 곰팡이 및 세균에 대한 B. velezensis의 길항 효과가 보고되어 있다(Kim 등, 2022; Reva 등, 2019). Bacillus spp.에 따라 생성하는 항생 물질이 다르고 식물병원체를 억제하는 능력이 달라 우수한 생물방제제 개발을 위한 길항미생물 탐색과 병원균에 따른 항균 활성 검정 연구가 필요할 것으로 생각된다.
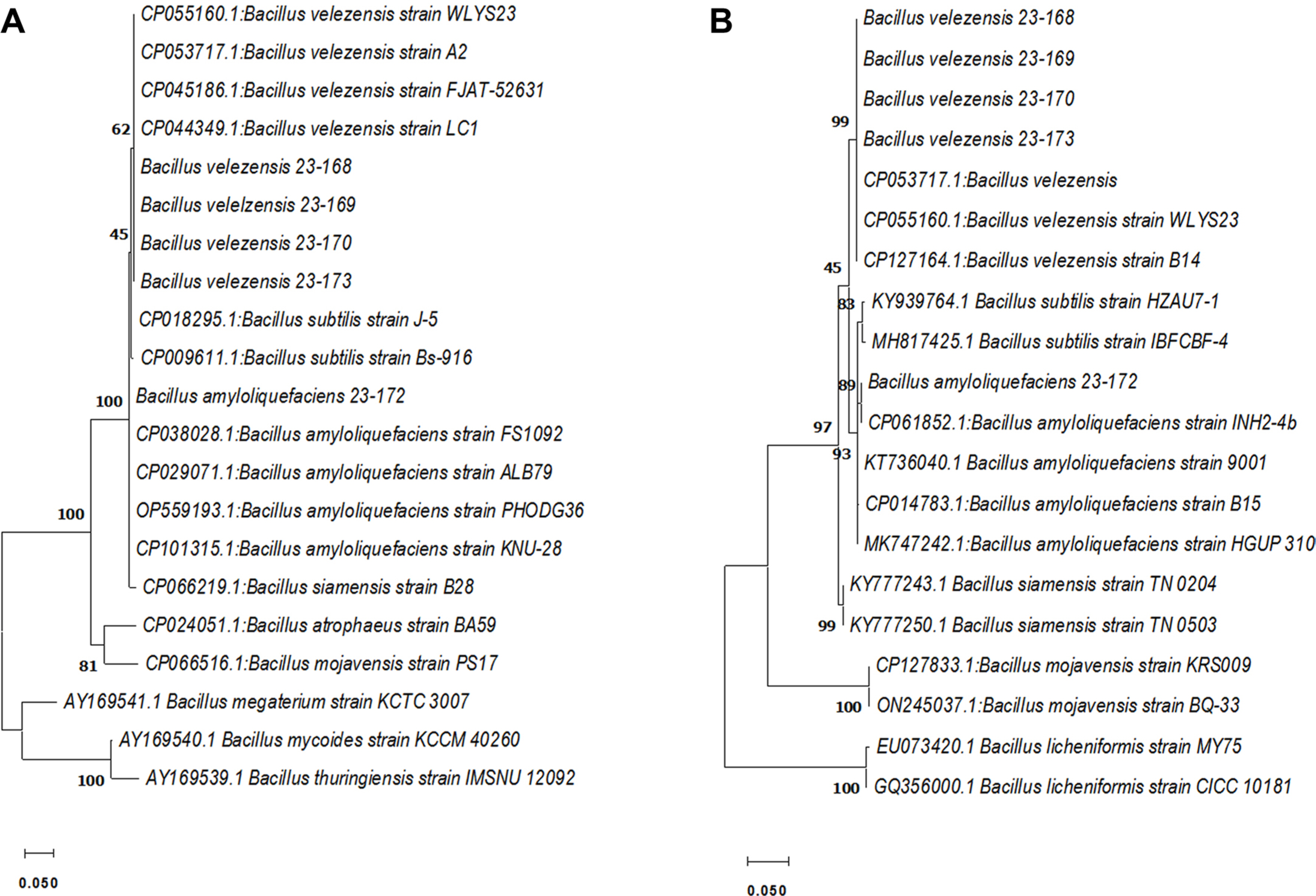
Phylogenetic relationship based on DNA gyrase A subunit (gyrA) (A) and RNA polymerase beta subunit (rpoB) (B) gene sequences of bacterial isolation with antifungal activity. A phylogenetic tree generated through maximum likehood analysis. The numbers above nodes indicate bootstrap values obtained from 1,000 replicates. Branch lengths are proportional to number of nucleotide changes. Scale bars=0.05 substitutions per site.
길항미생물의 균사생장억제효과 검정.
사과 겹무늬썩음병균인 B. dothidea 23-280과 대치배양을 통한 길항미생물의 균사생장억제효과를 검정하였다. 그 결과 23-168은 68.5%, 23-170은 68.7%로 균사생장억제율이 높았고, 23-173은 67.6%, 23-172는 66.0%, 23-169는 65.8%의 균사생장억제율을 나타내었다(Fig. 3).
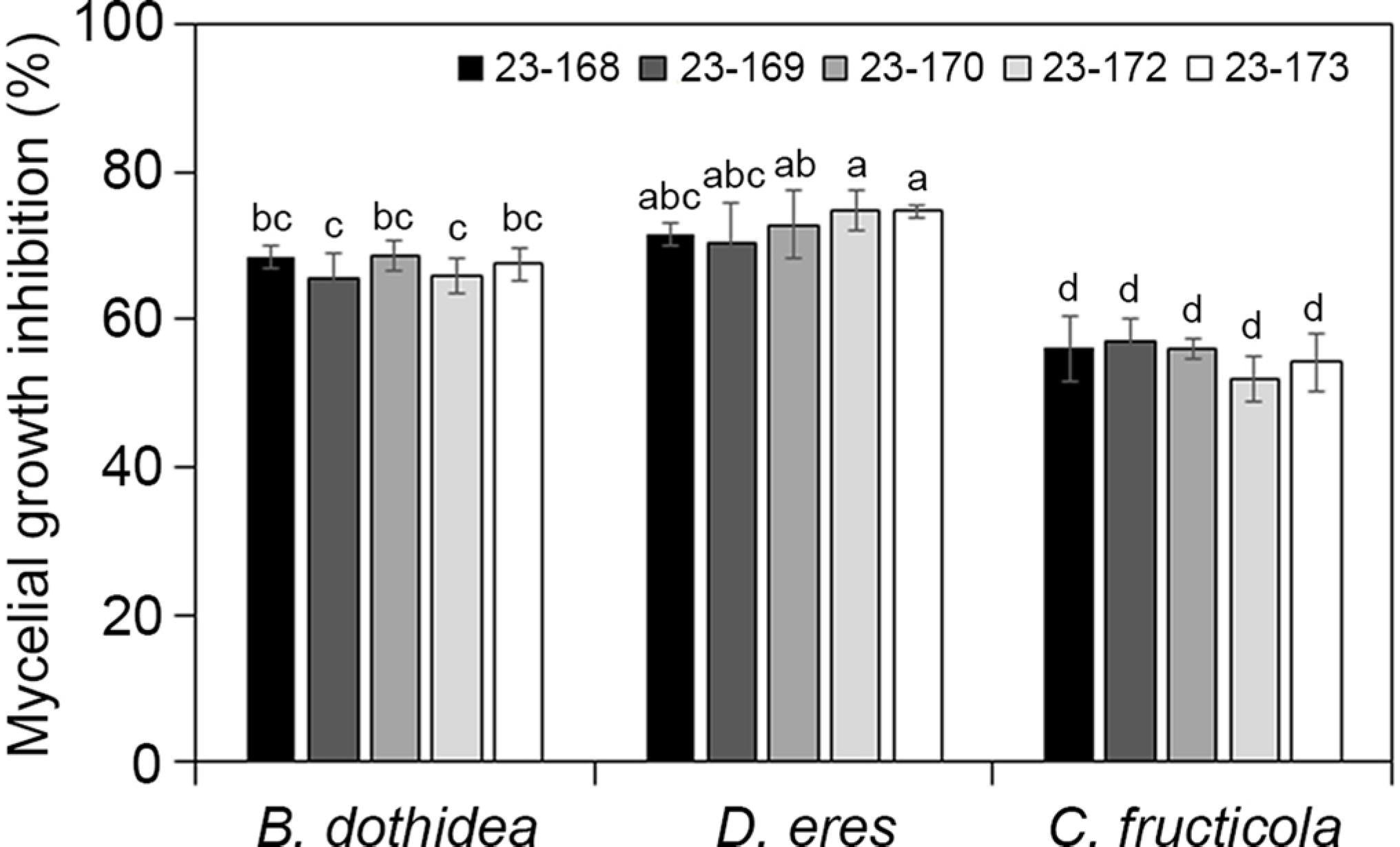
Inhibition ratio of mycelial growth of Bacillus spp. against plant pathogen Botryosphaeria dothidea, Diaporthe eres, and Colletotrichum fructicola. Error bars represent standard deviations over three replicates. Different letters on bars indicate significant differences according to Duncan's multiple range test at P=0.05.
사과 겹무늬썩음병균에 항균 활성을 가지는 길항미생물 5균주의 항균스펙트럼 범위를 알아보기 위해 사과에 병을 일으키는 다른 병원균과의 항균력을 조사하였다. 사과 과실에서는 겹무늬썩음병과 더불어 탄저병이 주요 문제가 되는 병해로, 탄저병의 발생은 연차 간 변동이 매우 크나 기후변화에 의해 발생량이 증가하고 있는 추세이다. 사과의 탄저병을 일으키는 C. fructicola 23-287과 대치배양을 수행한 결과, 23-168은 63.6%의 균사생장억제율을 보여 강한 항균 활성을 나타내었다. 그 외 다른 4균주도 50% 이상의 균사생장억제율을 나타내었다(Fig. 3).
사과 줄기에는 D. eres에 의한 줄기마름병이 주로 발생된다. 줄기마름병은 쇠약지에 발생하며 이병가지는 수피가 부패하며 암갈색으로 변하고 움푹 들어간다(Lee 등, 2006b). 선발된 5균주와 D. eres 21-281과 대치배양을 수행한 결과, 23-172와 23-173은 74.8%의 높은 균사생장억제율을 보였으며, 그 외의 3개의 균주도 70% 이상의 균사생장을 억제하였다(Fig. 3). 이와 같은 결과는 선발된 길항미생물이 사과 겹무늬썩음병균뿐 아니라 사과 과원에서 흔히 발생하는 탄저병과 줄기마름병 방제에 활용 가능성을 보여준다.
길항미생물의 활성효소 검정.
생물학적 방제제로 알려진 길항미생물은 cellulase, chitinase, protease, glucanase 등의 세포벽 분해효소를 분비하여 식물 병원성 곰팡이의 생장 억제 및 사멸시킨다(Compant 등, 2005; Venkataramanamma 등, 2022). 따라서 B. dothidea에 항균 활성을 보이는 5균주의 cellulase, protease의 활성을 검정하였다. 선발된 5균주는 CMC agar 배지에서 clear zone을 형성하여 cellulose를 분해하는 것을 확인하였으며 5균주의 평균 clear zone의 크기는 22.9–32.4 mm로 B. amyloliquefaciens 23-172가 가장 큰 clear zone을 형성하여 cellulase 활성이 우수하였다(Fig. 4). 또한 5균주는 skim milk agar 배지에서 clear zone이 형성되어 단백질을 분해하는 것을 확인하였으며 5균주의 평균 clear zone 크기는 18.3–25.6 mm이며 B. velezensis 23-169의 단백질 분해 능력이 가장 우수하였다(Fig. 4). 식물병원성 진균의 세포벽은 β-글루칸, 단백질, 키틴, 지질 등 복잡하게 구성되어 있어 celluase, protease, chitinase와 같은 가수분해 효소는 곰팡이의 세포벽을 약화시키는데 주요한 역할을 하며, 세포벽이 분해되면서 방출되는 탄소원이 길항미생물의 대사과정에 사용되기도 한다(Dimkić 등, 2022). Cellulase, protease, chitinase 등의 효소 활성을 갖는 Bacillus spp. 길항미생물은 이미 보고되어 있으며, 본 선발 균주에서도 강한 효소 활성이 확인되었다(Bhaskar 등, 2007; Nakamura 등, 1987).

Characterization of antagonistic substances produced by Bacillus spp. The ability of B. velezensis 23-168, 23-169, 23-170, 23-173 and B. amyloliquefaciens 23-172 on production of cellulase, protease and phosphate solubilization using in vitro assays.
또한 길항미생물은 불용성인산 가용화, siderophore 생산 등을 통해 식물생장 촉진에 도움을 주는 것으로 알려져 있다. 인은 식물 생장에 필수 영양요소이나 토양에는 식물이 이용할 수 없는 불용화 상태로 남아있는데, Bacillus subtilis, B. cereus, B. thuringiensis, B. pumilus, B. megaterium 등은 불용성 인산염을 분해하여 식물이 직접적으로 사용 가능한 형태로 가용화시켜 공급함으로써 식물생장촉진 효과에 도움을 준다(Saeid 등, 2018). 본 연구에서는 선발된 5균주의 불용성 인산에 대한 분해능을 확인해 보기 위해 Pikovskaya agar 배지를 이용하여 검정한 결과, 약간의 clear zone을 보여 불용성 인산에 대한 분해 능력이 있는 것을 확인하였다(Fig. 4). 따라서 본 연구에서 분리된 B. velezensis 23-168, 23-169, 23-170, 23-173과 B. amyloliquefaciens 23-172는 식물생장 촉진에도 도움을 줄 것으로 기대된다.
사과 과실에서의 겹무늬썩음병 발병 억제.
사과 과실에서의 겹무늬썩음병균에 대한 길항미생물의 방제 효과를 알아보기 위해 B. dothidea 23-280과 선발된 길항미생물 5균주를 과실에 동시 접종하여 병 발생 억제 정도를 조사하였다. 과실에서의 겹무늬썩음병징은 과점을 중심으로 갈색의 반점이 나타나고 점차 병반이 진전됨에 따라 엷은 테두리를 형성한다(Cheon 과 Jeon, 2015). 발생 병반의 크기를 측정하여 분석한 결과, 무처리구의 평균 병반의 직경이 36.8 mm임에 반해 23-168, 23-169, 23-170은 처리하였을 때 병반 크기가 크게 감소하였으며 각각 94.1%, 93.7%, 81.0%의 우수한 방제 효과를 나타내었다. 그 외 23-172, 23-173도 59.7%, 58.4%의 방제 효과를 나타냈다(Fig. 5).
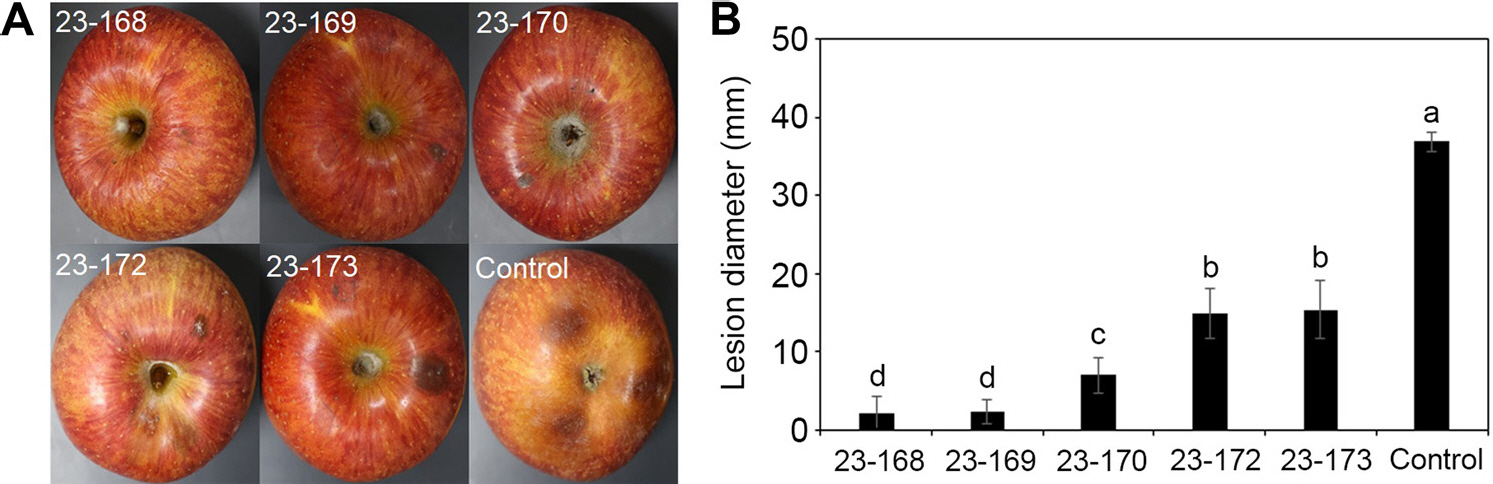
Suppression of disease development of white rot infection on sprayed apple fruits by Bacillus spp. suspensions. (A) The apple fruits were treated with bacterial suspensions. After drying for 1 hr, the fruits were inoculated with mycelium of Botryosphaeria dothidea under laboratory condition in square plates. After 7 days, this result was evaluted. (B) The lession diameter was was recorded 7 days after the incu-bation at room temperature. Treatment with B. velezensis 23-168 suspensions showing smaller lesions in comparison with the control. The lession diameter data is expressed in bar diagram.
미생물 농약은 화학농약에 비해 생태계에 미치는 영향이 거의 없으며, 약제 내성 등에 의한 약효가 감소하지 않고, 미생물 농약 개발 소요 비용이 적은 장점이 있다. 산업화된 대부분의 미생물 농약은 Bacillus spp.에 속하는데 내생포자를 만들어 열과 건조에 강한 특성으로 인해 대량의 미생물제 생산이 가능하며, 작물의 생육을 촉진하고 식물 병에 대응할 수 있는 항생 기작 물질을 생산하는 것으로 알려져 있다(Park, 2011). 본 연구에서 탐색된 길항미생물 5균주 중 B. velezensis 23-168은 사과 겹무늬썩음병균의 생장 억제와 병해 발생 억제 효과가 가장 우수하였고 더불어 탄저병균인 C. fructicola, 줄기마름병균인 D. eres와 같이 넓은 항균 스펙트럼을 보유하고 있다. B. velezensis 동일 종 내에서도 대치배양을 통한 길항 능력은 동일하지만 생산되는 lipopeptide의 종류와 생산 농도에 따라 식물체에서의 항균 활성은 다를 수 있다(Stoll 등, 2021). 비록 본 연구에서 길항미생물이 생성하는 lipopeptide 종류와 농도를 규명하는 연구는 수행되지 않았으나 cellulase 와 protease를 생산하고 난용성 인산염 분해능 또한 보유하고 있어 식물병원균 방제와 식물생장촉진을 위한 생물학적 방제제로써 활용 가능성이 있으며 미생물농약 개발에 유용한 기초자료가 될 것으로 판단된다.
Notes
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.
Acknowledgments
This work was carried out with the support of “Development of efficient detection and diagnosis technique for apple and peach latent pathogens in response to climate changes (Project No. RS-2020-RD009293)” Rural Development Administration, Republic of Korea.
Electronic Supplementary Material
Supplementary materials are available at Research in Plant Disease website (http://www.online-rpd.org/).