국내 과실 탄저병을 일으키는 종 복합체와 종 다양성 및 살균제 감수성
Colletotrichum Diversity within Different Species Complexes Associated with Fruit Anthracnose in South Korea and Their Fungicides In-Vitro Sensitivity
Article information
Abstract
탄저병원균(Colletotrichum) 속의 많은 식물병원균은 한국을 비롯하여 전 세계 과수 생산에 큰 위협이 된다. 사과, 감, 자두, 복숭아, 대추, 포도 및 호두와 같은 과실에서 탄저병과 관련된 탄저병원균의 종이 동정되었다. 형태적, 다중 유전자의 계통발생적 및 병원성 시험이 다양한 접근으로 실시되었다. 동정된 탄저병원균의 종에 대한 감수성은 살균제에 대하여 평가하였다. 2종의 종복합체인 gloeosporioides와 acutatum에 속한 9종의 탄저병원균이 국내 과실에 탄저병의 주요 원인균으로 동정되었다. Colletotrichum gloeosporioides 종 복합체 안에는 6종인 C. aenigma, C. fructicola, C. gloeosporioides, C. horii, C. siamense 및 C. viniferum이 있는 반면, Colletotrichum acutatum 종 복합체 안에 종은 C. fioriniae, C. nymphaeae 및 C. orientalis이 동정되었다. 사과 탄저병원균은 C. fructicola, C. siamense, C. fioriniae 및 C. nymphaeae, 자두 탄저병원균은 C. siamense, C. fioriniae 및 C. nymphaeae, 복숭아 탄저병원균은 C. siamense, C. fructicola 및 C. fioriniae, 감 탄저병원균은 C. siamense, C. horii 및 C. nymphaeae, 오미자 탄저병원균은 C. fioriniae, 호두탄저병원균은 C. orientalis, 대추탄저병원균은 C. nymphaeae, 포도 탄저병원균인 C. aenigma, C. fructicola 및 C. siamense를 국내 과수류의 과실에 병을 일으키는 병원균의 종류로 처음 국제학술지에 보고되었다. 이들 병원균의 종에 대한 살균제의 감수성 시험에서 여러 살균제에 대한 탄저병원균의 종 간에 EC50값이 매우 다양하여 감수성의 차이가 크게 나타났다.
Trans Abstract
Anthracnose, caused by the Colletotrichum genus, comprises a significant number of plant pathogens and poses a major threat to fruit production worldwide, including South Korea. Colletotrichum species were identified associated with anthracnose in fruits such as apple, persimmon, plum, peach, jujube, walnut, and grape. A polyphasic approach, including morphology, multigene phylogenetics, and pathogenicity testing, was used. Additionally, the in-vitro sensitivity of identified Colletotrichum species to common fungicides was also evaluated. A total of nine Colletotrichum species within two complexes, namely gloeosporioides and acutatum, have been identified as the causal agents of anthracnose in common fruits in South Korea. In the gloeosporioides complex, we found Colletotrichum aenigma, C. fructicola, C. gloeosporioides, C. horii, C. siamense, and C. viniferum. Meanwhile, in the acutatum complex, C. fioriniae, C. nymphaeae, and C. orientalis were identified. Notably, C. fructicola, C. siamense, C. fioriniae, and C. nymphaeae were reported for the first time from apple, C. siamense, C. fioriniae and C. nymphaeae from plum, C. siamense, C. fructicola, and C. fioriniae from peach, C. siamense and C. horii from persimmon, C. fioriniae from Omija (Schisandra), C. orientalis from walnut, C. nymphaeae from jujube, and C. aenigma, C. fructicola, and C. siamense from grape. Fungicide sensitivity tests revealed significant variation in the EC50 values among specific Colletotrichum species when exposed to different fungicides. Moreover, the same Colletotrichum species isolated from different host plants displayed varying sensitivity to the same fungicide.
서 론
전 세계적으로 장미과에 속하는 사과를 비롯한 일반 과수류의 과실에 발생하는 탄저병은 과실 생산에 직접적인 피해를 줌으로서 경제적으로 큰 손실을 일으키지만, 과수 이외도 다양한 많은 종류의 기주 식물 종(host species)을 가해한다. 주요 작물인 딸기, 수박 등 많은 쌍자엽 식물과 옥수수, 수수 등의 곡물에서 병을 일으키며, 양치류와 소나무에 대한 발병도 보고하였다(Dean 등, 2012).
탄저병원균은 전 세계적으로 분포하고 있으며 병원균 속(genus)에 많은 종은 넓은 기주 식물 범위를 가짐으로써 다양한 식물에 병을 일으키며, 경제적으로 피해가 큰 온대 과수류(사과, 복숭아, 감, 자두, 포도 등), 아열대 및 열대 과수류 등을 비롯하여 주요 곡물에서도 다양한 종이 병을 일으키고있으며, 지역별로 재배 작물과 환경조건에 따라서 발병을 일으키는 지역 고유의 병원균의 종이 다양하게 보고되고 있다(Dean 등, 2012).
탄저병의 일반적인 증상은 타원형이나 각진 모양의 어두운 괴사 병반이 나타나며, 발병은 식물의 어린 식물부터 성숙한 식물에 이르기까지 생육, 발달 및 수확 후에도 나타나는데, 탄저병원균은 비병원성 단계를 거치기 때문에 수확 후 증상이 나타나기도 한다(Bailey와 Jegger, 1992). 생물학적으로 탄저병원균(Colletotrichum spp.)은 독특한 반활물영양체로서 이 속에 속하는 곰팡이는 초기에 큰 세포내에 일차 균사와 관련된 짧은 활물영양단계를 거치면서 감염과 발병이 일어나고, 점차 기주 조직 전체에 퍼져 2차 균사를 형성하고, 2차 균사는 괴사 단계로 바뀌게 된다(De Silva 등, 2017).
탄저병을 일으키는 병원균(Colletotrichum lineola)은 1831년에 속과 종(species)이 소개되었고, 1937년 Corda에 의해 종명(Colletotrichum spp.)이 제안되면서 Colletotrichum은 Glomerellaceae (Glomerellales, Sordariomycetes)의 단일 속으로 보고되었다(Hyde 등, 2009; Sutton, 1992). von Arx (1957)는 Colletotrichum의 750종을 형태적인 특성으로 11개 분류군(taxa)으로 구분하였고, Sutton (1980, 1992)은 형태적인 특성과 배양적인 특성을 근거로 39종이 수용되었다. Colletotrichum 속의 분류는 1888–1975 사이에 638개 분류군이 보고되었고, 1976–2008년까지는 1년에 1개의 분류군이 보고되었다. 2000년에는 형태적, 배양 방법 및 병원성 연구를 근거로 40종이 새롭게 수용되었고(Cannon 등, 2000), 2009년 이후는 230개 분류 군이 추가로 보고되어 연평균 18.3 분류군이 보고되어 전체 228종이 되었다. 2012년 한 해만 58개 분류군이 추가되면서 정점에 이르게 되었고, 많은 연구에서 기존에 단일 종으로 보고되었던 종은 colletotrichum species complex (탄저병원균 종 복합체)로 보고를 함으로서 종 복합체에 대한 개념이 수용되는 계기가 되었다(Talhinhas와 Baroncelli, 2021). 2021년 6월 기준으로 탄저병원균의 종 복합체로 받아들여진 것은 Colletotrichum 속에 928 분류군으로 113개 다양한 infra-specific taxa와 806종이다(Talhinhas와 Baroncelli, 2021). 종 복합체의 연구는 병원균의 유전적인 유연 관계를 계통발생(phylogeny) 분석을 하기위하여 다중유전자(ACT [actin], CHS-1 [chitin synthase], GAPDH [glyceraldehyde-3-phosphate dehydrogenase], ITS [internal transcribed spacer], TUB2 [β-tubulin])의 염기서열을 253개 reference 균주의 자료를 활용한 유전자 지도를 처음 보고하였다(Price 등, 2010). 그 이후 탄저병원균에 대한 다양한 유전자의 염기서열 분석은 병원균에 대한 유연관계를 분석하는 도구로 활용함으로서 형태적인 동정의 한계를 극복하게 됨으로써 새로운 종이 많은 동정하게 되어 2012년은 9개의 종 복합체가 보고되었다(Cannon 등, 2012; Damm 등, 2012a, 2012b; Weir 등, 2012). Damm 등(2012a)은 국내 과수류의 거의 모든 탄저병을 일으키는 주요 병원균의 종이 포함된 acutatum species complex (acutatum 종 복합체)를 보고하였고, Weir 등 (2012)는 gloeosporioides species complex (gloeosporioides 종 복합체)을 보고하였다.
많은 연구에서 다양한 유전자의 염기서열 자료를 기반으로 유연관계를 분석하여 종을 동정하는 방법이 확립되면서 기존에 종명이 새로운 종명으로 바뀌게 되었다. 2009년 이후 기존에 보고된 원종명(original species)이 최근 종명(current species)으로 10개 종이 바뀌게 되었다. 이들 종 중에는 과거에 다른 종명으로 보고되었던 종은 gloeosporioides 종 복합체에 속한 종은 C. siamense, C. fructicola 및 C. aenigma이고, acutatum 종 복합체에 속한 종은 C. nymphaeae이다(Talhinhas 와 Baroncelli, 2021). 최근 종명으로 바뀐 C. siamense는 과거에 5종류의 다른 종명(원종명: C. communis, C. dianesei, C. endomangiferae 및 C. melanocaulon)으로 보고되었으나, Sharma 등(2015)은 최근 종명으로 보고하였다. C. fructicola 는 과거에 보고된 원종명은 C. ignotum이었으나 Weir 등(2012)은 최근 종명으로 보고하였고, Liu 등(2013)은 C. populi 을 최근 종명인 C. aenigma으로 보고하였다. 원 종명이 C. citri 로 보고되었으나, Damm 등(2012a)은 C. nymphaeae로 보고하였다. 본 리뷰는 탄저병원균에 대한 정확한 동정 방법, 지리적발생분포, 병원균의 기주 특이성, 지리적 발생 고유종, 국내 과수류에 발생하는 병원균의 종 다양성, 병원균의 종류별 살균제에 대한 감수성을 고찰하고, 많은 종류의 과수가 수입됨에 따른 새로운 종의 도입을 차단하기 위한 종 동정과 병 방제에 대한 기초자료를 제공하고자 한다.
탄저병의 지리적 발생 분포와 병원균의 종류
탄저병은 최근 10년간(2010–2020년) 전 세계적으로 2,717건을 보고하여 가장 많은 병 발생 보고를 하였다(Talhinhas와 Baroncelli, 2021). 국가별 병 발생 연구 보고를 보면, 중국에서 발생하는 탄저병이 전 세계에서 발생하는 건수의 25.6%로 가장 많았고, 브라질 9.4%, 호주 8.5%, 미국 8.1%, 이탈리아, 일본 및 뉴질랜드가 각각 4–5% 순이다. 탄저병을 일으키는 주요 병원균의 종류는 17종이 관여한다고 보고하였다(Talhinhas와 Baroncelli, 2021).
전 세계적으로 가장 많은 탄저병을 일으키는 종은 gloeosporioides 종 복합체 와 acutatum 종 복합체에 속한 종이다. 이들 종은 아시아에서 발병이 가장 많은 주요 병원균이다(Talhinhas와 Baroncelli, 2021). Gloeosporioides 종 복합체에 속한 종 중에는 C. siamense, C. fructicola 및 C. gloeosporioides는 아시아에서 가장 많은 병을 일으키는 병원균이며, 국내 과수류의 과실에 주요 병원균이기도 하다(Chang 등, 2018a; Hassan 등, 2019b; Jeon 등, 2017; Kim 등, 2018, 2021). C. siamense는 6대륙 전체 발생률 228건 중 144건(63.1%)이 아시아에서 발병한다. C. fructicola에 의한 병 발생 건수는 6대주 전체 발생건수 176건 중 113건(62.4%)이 아시아에서 병을 일으키며, C. gloeosporioides는 6대주 전체 발생 217건 중 아시아에서 110건(50.7%)이 아시아에서 병을 일으킨다. Acutatum 종 복합체에 속한 병원균으로 국내 과수에서 병을 일으키는 종은 C. fioriniae, C. orientalis, C. nymphaeae 및 C. scovillei이다. 이들 종 중 C. fioriniae, C. nymphaeae 및 C. orientalis 국내 과수류에 주요 병원균이다(Hassan 등, 2019a, 2019b; Jang 등, 2023; Kim 등, 2020, 2022).
Acutatum 종 복합체에 속한 종으로 국내 대부분의 과실에서 병을 일으키는 C. fioriniae와 C. nymphaeae는 전 세계 발병 건 수는 다음과 같다(Talhinhas와 Baroncelli, 2021). C. fioriniae 는 전 세계 발병 건수가 134건으로 북미가 43건으로 가장 많고, 아시아 36건 및 유럽 33건으로 3대륙 간에 큰 차이를 보이지 않고 발병하는 병원균으로 남미나 아프리카에서는 각각 1건의 발병 보고가 있다. 반면, C. nymphaeae는 전체 발생 건수 118건중 유럽에서 가장 많이 발생하는 병원균(39건)이고, 아시아(28건), 남미(26건), 북미(15건) 및 아프리카(8건)등에서 보고된 병원균으로 acutatum 종 복합체에 종 중에서 전 세계적으로 가장 다양하게 발병하고 있다. C. scovillei는 국내 고추에 주요 병원균으로 전 세계 전체 발병 건수 42건 중 아시아에서 36건이 발생하고, 남미가 5건으로 지역적인 발병 환경의 과 기주 특이성이 있는 병원균으로 지역 고유종으로 구분할 수 있는 병원균으로 과수에서는 아직 발생보고가 없다.
탄저병원균의 기주 특이성
탄저병원균은 대부분 쌍자엽식물에서 병을 일으키는데, 병 발생은 약 77%가 기주와 병원체의 종 과의 친화적인 관계에 의해 일어난다. 단자엽식물 기주에서 발병을 일으키는 병원균은 caudaum, gramicola 및 spaethianum 종 복합체에 속한 종에 의해 주로 병을 일으킨다(Talhinhas와 Baroncelli, 2021). 기주 식물 종(host species)과 탄저병원균의 종 간에 발병 조합을 보면 1,358개 기주-병원균의 종 간에서 720개의 기주에서 병을 일으킨다. 이들 병원균의 종 중에서 goeosporioides 종 복합체에 속한 C. siamense와 C. gloeosporioides가 가장 많은 기주를 가지고 있고, 기주 특이성이 높다. C. siamense는 103개의 기주 식물 종에서 병을 일으키고, C. gloeosporioides는 87개 기주식물에서 병을 일으키고, C. fructicola는 63개의 기주식물이 있고 다양한 식물과의 기주에서 서식한다. 기주 특이성이 높은 병원균의 경우는 여러 종이 항상 서식한다. Acutatum 종 복합체에 속한 종 중에는 C. fioriniae는 가장 많은 73개 기주 식물과 C. nymphaeae는 42개 기주식물에서 병을 일으킨다.
탄저병원균은 기주 식물 종, 기주 식물의 속 및 기주 식물의 과(family)에 대한 특이성이 있다. 속에 대한 특이성을 보이는 탄저병원균의 종은 루핀꽃 식물에 탄저병을 일으키는 C. lupini 으로, acutatum 종 복합체에 속한 종으로 분기군(clade)을 이루는 종이다(Damm 등, 2012a). 그 외 차나무와 동백나무에 탄저병을 일으키는 C. camelliae가 있고, 국화과(Asteraceae)에는 C. carthami와 C. chrysanthemi가 병을 일으킨다. Orchidearum 종 복합체에 속한 종인 C. sojae는 콩과 식물(Fabaceae)에서만 주로 탄저병을 일으키고, graminicola 종 복합체에 속한 종인 C. cereal은 벼과식물(Poaceae)에서만 병을 일으키지만, 종 복합체에 특정 병원균의 종은 품종에 특이성을 보이는 경우도 있다(Talhinhas와 Baroncelli, 2021). 국내 재배되고 있는 감나무는 크게 곶감용과 홍시용으로 구별되며, 이들 감에 탄저병을 일으키는 병원균의 종은 다르다(Jeon, 2017). 청도 지역을 중심으로 재배되는 홍시용 감(품종명: 반시)은 청도군(6개면: 20개 과수원)에서 채집한 모든 균주에서 C. siamense만 동정되었고, 곶감용으로 재배(상주, 영동, 산청)하는 감(품종: 둥시)에서는 모두 C. horii가 동정되었다(Jeon, 2017). 국내 사과 탄저병원균도 기주 특이성이 높고 친화성이 높은 감수성 품종인 홍로는 5종의 병원균이 동정되었고, 후지 품종은 4종의 병원균이 동정되었다(Kim, 2019).
탄저병원균이 식물의 과 단위에서 서식하는 기주식물의 종 수, 탄저병원균의 종 수, 기주-병원균 조합 및 종 복합체의 종류는 다양하다. 장미과(Rosaceae: 사과나무 등)에서 탄저병을 일으키는 병원균의 종수는 41개, 기주 식물의 종수는 31개, 병원균의 종-기주 조합(Colletotrichum species host combination) 수는 118개이고, 종 복합체는 7개가 관여한다고 한다(Talhinhas와 Baroncelli, 2021). 콩과(Fabaceae) 식물은 가장 다양한 탄저병원균의 종 복합체가 관여한다. 탄저병원균의 종 수는 36개, 기주의 종 수는 가장 많은 51개이며, 11개 종 복합체의 병원균이 관여하고 있고, 병원균의 종-기주 조합 수는 장미과 다음으로 많은 87개이다. 가지과(Solanaceaea: 고추등) 식물에서 14개 기주식물에서 탄저병을 일으키는 병원균은 10개 종 복합체에 속한 41종이 병을 일으키고, 병원균의 종-기주 조합 수는 72개이다. 그 외 탄저병원균의 종류가 10종 이상이 기주 식물에 서식하면서 병을 일으키는 식물 과의 수는 26개이고, 병원균의 종류가 20개 이상이 서식하면서 병을 일으키는 식물 과의 수도 12개이다(Talhinhas와 Baroncelli, 2021).
전 세계적으로 식물에 가장 많은 병을 일으키는 병원균은 gloeosporioides 종 복합체로 516병원균의 종-기주 식물 종과의 연관되어 있다(Talhinhas와 Baroncelli, 2021). 병원균의 종과 기주 식물의 과 단위는 880개로 특별하게 연관성이 있다. 종 복합체별로는 gloeosporioides 종 복합체 가장 많아 전체 36.8%을 차지하고, acutatum 종 복합체는 20.9%이고, boninense 종 복합체가 9.7%를 차지하고 나머지 종복합체들은 각각 3–5% 범위에 속한다. 종 복합체의 종류별 기주 범위는 acutatum, gloeosporioides, truncatum 종 복합체에 속한 병원균은 기주 범위가 넓어서 평균적으로 탄저병원균 1종류당 7개 종 이상의 기주 식물을 가지고 있는 반면, agaves, caudatum, dracaenophilum 및 graminicola 종 복합체는 기주 범위가 좁아 탄저병원균 1종당 1–2개 종의 기주만 가지고 있다(Talhinhas와 Baroncelli, 2021).
탄저병원균의 종 복합체 (Collectotrichum Species Complex)
탄저병원균은 자낭균류와는 다르게 MAT1-2-1 유전자만 사용하여 유성 생식이 가능하다(Liang 등, 2021; Menat 등, 2016). 2021년 6월 현재 Index Fungorum에는 Colletotrichum 속의 928개 분류군, 종 순위의 806개, 나머지 113개의 분류군이 다양한 하부 종 분류군으로 나열되어 있으며 주로 formae 및 varietas 순위에 있다. Baroncelli 등(2017)은 탄저병원균을 11개 종 복합체에 189종을 보고하였으나, 최근 Talhinhas와 Baroncelli (2021)는 전 세계에서 발생하는 병원균은 15개 탄저병원균의 종 복합체이며, 257종이 있고, 아직도 종 복합체에 포함되지 않은 단일 종도 10개 있다.
전 세계적으로 가장 많은 병을 일으키는 gloeosporioides 종 복합체는 Weir 등 (2012)이 처음 보고하였고, 그 후 Talhinhas 와 Baroncelli (2021)는 gloeosporioides 종 복합체에 속한 종은 57개이고, 이들 병원균 중 24개 종은 일반적으로 많이 알려진 종이고, 26개 종은 아직도 data가 충분하지 않은 종이고, 7종은 없어질 가능성이 있는 불안정한 종으로 분류하고 있다. Acutatum 종 복합체도 Damm 등(2012a)은 처음 보고하였고, 종복합체에는 5종의 분기군(계통군)의 종을 포함하여 29개 아분기군(subclade)에 31개 종이 있고, 이 중 21개 종은 새로운 종으로 보고하였다. 그 후 Talhinhas와 Baroncelli (2021)는 Acutatum 종 복합체에는 6개 주 분기군(clade)의 종을 포함하여 전체 41개 종이 있으며, 일반적으로 잘 알려진 종은 19개이고, 14종은 여전히 자료(data)가 충분하지 않은 종이며, 8종은 불안정한 종으로 분류하고 있다. Boninense 종 복합체에는 26개 종이 있고, 잘 알려진 종은 4개이고, data가 충분하지 않은 종은 16개 종이고, 6종은 불안전한 종으로 분류하고 있고, Spaethianum 종 복합체에는 9개 종이 있다. 그 외 caudatum, gigasporium, magnum, orbicula, dracaenophilum 및 orchidearum 종 복합체에는 각각 8개 종이 포함되어 있고, agaves 종 복합체에는 5개 종이 있고, truncatum 종 복합체에는 4개 종이 포함되어 있다. Cannon 등(2012)은 Graminicola 종 복합체, dematium 종 복합체, destructivum 종 복합체, spaethianum 종 복합체, truncatum 종 복합체 및 orbiculare 종 복합체를 최초로 보고하였고, boninense 종 복합체는 Damm 등(2012b)이 보고하였다. 2014년에는 caudatum 종 복합체(Crouch 등, 2014)와 gigasporum 종 복합체가 보고되었고(Liu 등, 2014), 2019년에는 magnum 종 복합체, Dracaenophilum 종 복합체 및 orchidearum 종 복합체가 보고되었고(Damm 등, 2019), 2021년에는 agaves 종 복합체가 보고되었다(Bhunjun 등, 2021).
탄저병원균의 종 복합체의 동정
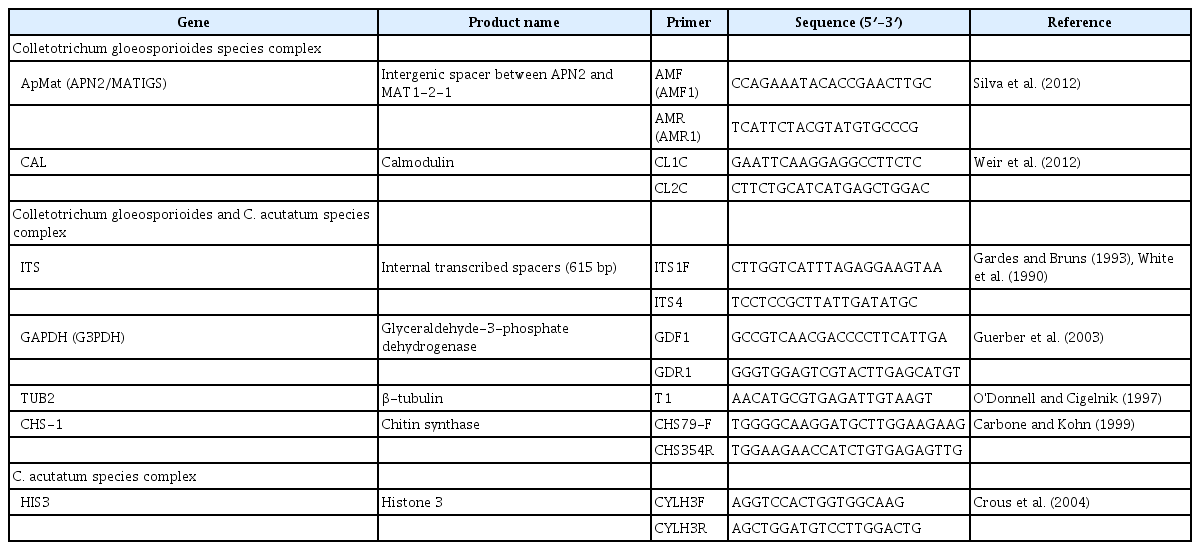
곰팡이 병원균의 동정은 ITS rDNA 영역의 염기서열 분석으로 시작되었고, 탄저병원균의 일부 종(C. graminicola와 C. gigasporum)을 구분하는 데는 사용하였지만(Jayawardena 등, 2016; Liu 등, 2014), ITS 염기서열 분석만으로 종을 동정하는 것은 한계가 있다(Hofstetter 등, 2019). 대부분의 탄저병원균의 종을 동정하기 위해서는 APMAT (intergenic spacer between APN2 and MAT1-2-1), APN2 (DNA lyase C), CAL (calmodulin), CHS-1, GAPDH, GS (glutamine synthase), HIS3 (histone 3), ACT, SOD2 (manganese-superoxide dismutase) 및 TUB2 유전자의 염기서열의 분석자료를 병합하여 계통수(Bayesian inference phylogenetic tree)를 제작하고 계통학적 관계를 분석하다(Jayawardena 등, 2016, 2021; Marin-Felix 등, 2017). 계통발생수의 분석은 여러 방법이 있다(Price 등, 2010; Ronquist 등, 2012).
탄저병원균의 종은 형태적인 특징과 핵산의 염기서열의 자료인 ITS와 GAPDH만으로 동정은 충분하지 않고(Silva 등, 2012; Weir 등, 2012), C. siamense의 동정에는 APMAT 유전자의 염기서열 분석이 반드시 필요하다(De Silva 등, 2017; Liu 등, 2018). Weir 등(2012)은 gloeosporioides 종 복합체에 속한 종의 동정에는 GAPDH와 TUB2 유전자의 염기서열은 종 복합체 안에 대부분의 종을 구분하는 데 필요하고, CAL 유전자의 염기서열은 C. siamense와 C. fructicola의 종의 구분을 위해서는 다른 유전자(ITS, GAPDH, TUB2, ACT, CHS-1) 염기서열보다 좋다.
국내 주요 과수 탄저병을 일으키는 C. gloeosporioides 종 복합체에 속한 여러 종 동정과 C. acutaum 종 복합체에 속한 종 동정을 위한 유전자의 종류는 Table 1과 같다. C. gloeosporioides 종 복합체의 종 동정에는 ITS (Gardes와 Bruns, 1993), CHS-1 (Carbone과 Kohn, 1999), TUB2 (Glass와 Donaldson, 1995), GAPDH (Templeton 등, 1992), CAL (Weir 등, 2012), ACT (Carbone과 Kohn, 1999) 및 APMAT (Silva 등, 2012)의 염기서열을 분석으로 동정이 가능하다(Weir 등, 2012).
C. acutaum 종 복합체를 동정하기 위해서는 ITS, CHS-1, TUB2, GAPDH, ACT 및 HIS3의 유전자 염기서열을 분석하여야 정확한 동정이 가능하다고 한다(Crous 등, 2004; Damm 등, 2012b; Dowling 등, 2020).
C. gloeosporioides 종 복합체의 동정은 Bayesian inference phylogenetic tree는 다중유전자(ITS, CHS-1, TUB2, GAPDH, ACT, CAL, GS, SOD2, APMAT 및 HIS3)의 염기서열 분석이 필요하다(Dowling 등, 2020; Hassan 등, 2018; Kim 등, 2020; Talhinhas와 Baroncelli, 2021). 지금까지 다양한 유전자의 염기서열 자료로 계통발생을 분석하는 방법은 다양하다(Katoh와 Standley, 2013; Kumar 등, 2016; Price 등, 2010; Ronquist 등, 2012).
국내 과수류의 탄저병원균의 종 복합체의 종류와 특성
국내 주요 과수나무의 과실에 발생하는 탄저병은 6월 하순부터 발병하기 시작하여 수확기까지 발병하며, 이미 감염 이병 과실은 유통과 저장 중에도 과실에 큰 피해를 준다. 병징의 특징은 과실 표면의 병반 부위가 윤문이 선명하게 나타나며, 경시적으로 함몰되어 병반 포면에 둥근 무늬를 띠며 분생자 층이 형성된다. 사과의 이병과는 자른 과실의 단면은 과심을 중심으로 V자 형태로 과실 부패가 진행되는 것을 볼 수 있다(Cheon 등, 2016).
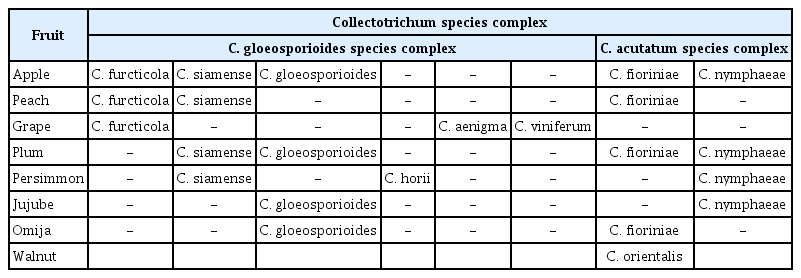
국내 과수류에 발생하는 탄저병원균의 종 복합체의 종류는 C. gloeosporioides 종 복합체와 C. acutaum 종 복합체에 의해 발생한다. 사과, 감, 자두, 복숭아, 포도 및 대추에서 2종류의 종 복합체와 종 다양성은 Table 2와 같다(Chang 등, 2018a, 2018b; Hassan 등, 2018, 2019a, 2019b; Kim, 2019; Kim 등, 2018, 2020, 2022; Lee 등, 2018, 2020a, 2020b; Lim 등, 2020).
Colletotrichum gloeosporioides 종 복합체
C. gloeosporioides 분류는 Penzig (1882)이 보고한 이후 100년 이상 여러 세대에 걸쳐 바뀌게 되었다(Weir 등, 2012). Cannon 등(2008)은 현재 C. gloeosporioides 또는 C. gloeosporioides sensu stricto는 감귤에 탄저병을 일으키는 병원균으로 보고하였다. 기주식물은 Ficus, Mangifera, Pueraria 및 Vitis을 비롯하여 광범위한 기주 범위를 가지는 국제적인 곰팡이로 지난 20년간 더 많은 수의 기주와 지역에서 발병을 보고하였다(Fantinel 등, 2017; Shi 등, 2019).
C. gloeosporioides 종 복합체는 형태적, 유전 계통학적으로 특이하고 다양한 종을 포함하고 있다(Weir 등, 2012). 과거 종들에 대한 유전적인 유연관계를 계통발생분석으로 재동정을 한결과 C. gloeosporioides는 기존에 보고되지 않은 새로운 많은 종을 포함하고 있는 종 복합체이고, 이 종 복합체에 속에는 22종과 1개 아종이 있고, 2개의 종 분기군/계통군(clade)인 바나나 탄저병원균(C. musea)과 커피 탄저병원균(C. kahwae)에서 여러 종이 분화가 되었다(Weir 등, 2012). 최근 Talhinhas와 Baroncelli (2021)는 3종의 분기군의 종으로 C. theobromicola, C. kahawae 및 C. gloeosporioides이며, 이들 종에서 분화가 되어 오늘날 57개의 종이 되었다고 보고함으로서 Weir 등(2012)가 보고한 분기군의 종에서 차이를 보였다. 이들 분기군의 종은 병원균은 매우 강력하게 종 간에 계통 발생적인 거리(phylogenetic distances)가 있다고 한다. C. gloeosporioides 종 복합체에 속한 대부분의 종은 여러 기주를 침입하여 병을 일으키는 다범성(polyphagous)이다. 그리고, 몇몇 종은 하나의 기주에서 강력하게 병을 일으키는 특화된 종이다(Talhinhas와 Baroncelli, 2021). C. kahawae는 아프리카 대륙의 토착 병원균으로 아라비카 커피 열매에 탄저병을 일으키며, 침입력이 강하여 녹색 커피 열매에 특이하게 감염시켜 거대한 경제적인 손실을 가져온다(Waller 등, 1993). 현재는 C. kahawae는 검역대상병원균과 생물학적무기 병원균으로 등록되어 있다(Batista 등, 2017). 최근 Kim 등 (2022)은 국내에서 한약재로 사용하는 삽주 식물에서 잎에 탄저병을 일으키는 7종의 병원균 중에 C. kahawae를 동정하여 보고하였다.
C. siamense와 C. fructicola는 태국 북쪽 지방에서 재배하는 아라비카 종의 커피 열매에 병을 일으킨다고 처음 보고되었다(Prihastuti 등, 2009). 이 두 종은 생물학적, 지리적으로 다양하며, 분생포자의 크기의 다양함도 유사하다. 특히 분생포자의 길이는 C. siamense가 C. fructicola보다 약간 짧지만, 분생포자의 폭은 거의 유사하다(Weir 등, 2012). C. siamense의 분생포자의 길이는 병원균을 분리한 기주의 종류나 배양 조건에 따라 크기의 차이가 있다(Prihastuti 등, 2009; Yang 등, 2009). Potato dextrose agar (PDA) 배지에 접종한 병원균을 28°C 암 조건에서 배양하면 C. fructicola가 C. siamense보다 균총의 성장 율이 크고 부착기 크기도 크다. 이들 종간의 구분은 SOD2, CAL과 TUB2 유전자의 염기서열 분석으로 구분할 수 있으며(Weir 등, 2012), Hu 등(2015)은 3종의 유전자(GAPDH, TUB2, ACT)의 염기서열 분석에 의한 계통발생분석을 하면 종 복합체 안에서 C. siamense와 C. fructicola를 명확하게 구분할 수 있다.
C. fructicola의 무성세대의 형태와 도해는 Rojas 등(2010)이 보고하였고, 유성세대 형태와 도해는 Fu 등(2019)이 보고하였다. 이 병원균은 내부기생과 부생균(endophyte and a saprobe)으로 전 세계적으로 분포하며 넓은 범위의 기주 식물을 가지고 있어 모든 대륙에서 병을 일으킨다(Jayawardena 등, 2016). 이 병원균은 대부분이 열대와 아열대지역에서 병을 일으키며, 전형적인 탄저병증상을 보이며, 남미 지역에서는 사과탄저병(bitter rot)을 일으키는 주요 병원균이다(Alaniz 등, 2019; Velho 등, 2019).
C. siamense (syn. C. hymenocallidis; syn. C. jasminisambac)와 C. fructicola의 형태적인 특징은 아라비카 커피 열매 탄저병을 보고한 Prihastuti 등(2009)이 무성세대 형태와 도해를 보고 하였고, 유성세대 형태는 Fu 등(2019)이 보고하였다. C. siamense 와 C. fructicola는 기주 범위가 매우 넓은 곰팡이로 전 세계에서 발생한다. 호주와 열대 아메리카에는 널리 분포하고 있지만, 유럽에서는 매우 드문 병원균이다(Jayawardena 등, 2016; Prihastuti 등, 2009). 감나무의 탄저병원균으로 처음 보고된 C. horii는 덜 익은 과실, 어린 줄기 및 가지에도 병을 일으키며, 이 병원균은 한국, 일본, 중국, 뉴질랜드 및 브라질에서 분포하며(Weir와 Johnston, 2010), 브라질에서는 나뭇가지 마름병 및 고엽병의 원인균으로 보고되었고(May De Mio 등, 2015), 한국은 단감과 떫은 감에 탄저병원균으로 보고되었다(An 등, 2018; Jeon 등, 2017; Kwon 등, 2013).
C. acutatum 종 복합체
C. acutatum은 Simmonds에 의해 1965년에 처음으로 호주에서 파파야(Carica papaya)의 병원균으로 보고한 이후 단일 종으로 분류하고 있었으나 유전자 염기서열 분석, 형태학적 및 계통발생분석으로 이 종은 다양한 종을 함유하고 있는 C. acutatum 종 복합체로 보고하였다(Lardner 등, 1999). C. acutatum 종 복합체에 속한 종은 90% 이상은 쌍자엽 식물에서 병을 일으키고, 형태학적, 생리학적, 생식 및 유전자의 데이터를 기반으로 여러 종 내 그룹을 확립하였다(Sreenivasaprasad와 Talhinhas, 2005). C. acutatum 종 복합체에 속한 여러 종은 제한된 지리적 분포와 기주 범위를 가지고 있지만, C. acutatum, C. fioriniae, C. godetiae 및 C. nymphaeae과 같은 일부 종은 글로벌 종으로 많은 기주를 갖고 있다(Baroncelli 등, 2017). 국내 과수류에 탄저병을 일으키는 병원균은 C. fioriniae와 C. nymphaeae이고, 호두에 탄저병원균은 C. orientalis가 보고되었다(Chang 등, 2018b; Hassan 등, 2019a, 2019b; Jang 등, 2023; Kim 등, 2020, 2022; Lee 등, 2020a).
Damm 등(2012a)은 C. acutatum 종 복합체에는 31종이 있고, 이중 21종은 보고되지 않은 신규 종이고, 5종은 계통/분기(clade)종으로 보고하였고, 이후 Talhinhas와 Baroncelli (2021)은 41종을 보고하면서 6종은 어느 정도의 지리적 구조를 지닌 계통/분기을 이루는 종으로 구분하고 있다. C. nymphaeae 는 계통군(분기군)의 종으로 9종이 동일 그룹을 형성하고 있고, C. acutatum과 C. fioriniae는 단일 계통군(분기군)의 종이다(Damm 등, 2012a).
C. nymphaeae는 Nymphaeae alba/Nuphar luteum으로 처음 보고되었고(Van Der AA, 1978), 넓은 기주 범위를 갖고 있으며 최근에는 딸기에 가장 중요한 병을 일으키는 종이다(Damm 등, 2012a; Nam 등, 2023).
C. acutatum과 C. fioriniae는 전 세계적으로 분포하는 종으로 C. acutatum은 오세아니아 또는 인도양 지역에서 유래한 종이다(Damm 등, 2012a). Shivas와 Tan (2009)에 의해 처음 신규 종으로 분리된 C. fioriniae는 북반구에서 유래한 종으로 모든 대륙과 광범위한 기주 식물에서 발병하지만 대부분 온대 지역에서 발생하는 국제적인 병원균이다(Talhinhas와 Baroncelli, 2021). 이 병원균은 일반적으로 탄저병 증상과 관련된 다른 Colletotrichum spp.과 함께 발생하지만 병원성이 약하다. 한국, 유럽 및 북미에서 사과 탄저병을 일으키는 병원균이다(Grammen 등, 2019; Munda, 2014; Munir 등, 2016).
사과 탄저병원균의 종 다양성
국내 사과에 탄저병을 일으키는 병원균의 종 다양성은 사과 주산지인 경상북도 문경, 상주, 영주, 의성, 청송의 과수원에서 품종별로 다양한 병징을 보이는 이병과를 채집하여 형태적 특징과 유전자의 염기서열 분석하여 계통발생분석으로 계통수로 동정한 결과는 Table 2와 같이 gloeosporioides 종 복합체에 속한 3개 종과 acutatum 종 복합체에 속한 2개 종이다. 이 중 4개 종은 보고되지 않은 미기록 종이었다(Kim 등, 2018, 2020; Oo 등, 2018; Park 등, 2018).
Gloeosporioides 종 복합체에 속한 종은 C. siamense, C. fructicola 및 C. gloeosporioides이고, acutatum 종 복합체에 속한 종은 C. fioriniae와 C. nymphaeae이다(Kim 등, 2020). 기존에 한국식물병명목록에 보고된 종은 C. gloeosporioides와 C. acutatum이었고(Korean Society of Plant Pathology, 2009), C. acutatum은 최근까지 과실의 탄저병에서 분리 동정이 되지 않았다. 사과의 품종별로는 탄저병에 감수성 품종인 홍로는 2개의 종복합체에 속한 5종이(C. siamense, C. fructicola, C. gloeosporioides, C. fioriniae, C. nymphaeae) 모두 분리 동정되었고, 후지 품종은 4종이 분리 동정되었다(Kim, 2019). Gloeosporioides 종 복합체에 속한 종은 C. siamense, C. fructicola 및 C. gloeosporioides은 계통발생적으로 바나나 탄저병원균(C. musea)에서 분화된 종이다(Weir 등, 2012)
한국식물병명목록에는 탄저병의 병원균은 유성세대인 Glomerella cingulate Spauld & H. Schrenk 와 무성세대인 C. gloeosporioides Penz. & Sacc (무성세대)로 기록하고 있다(Korean Society of Plant Pathology, 2009). 국내 사과 탄저병은 1967년 박갑용 등이 경북지구 사과 개발에 관한 종합적 연구로 최초 보고되었다(Korean Society of Plant Pathology, 2009). 한국식물병명목록에 기술된 G. cingulate의 월동 자낭포자는 Kim (1971)이 처음 보고하였고, C. acutatum에 의한 탄저병은 Lee (1994)가 보고하였다(Korean Society of Plant Pathology, 2009).
전 세계적으로 사과에 발생하는 탄저병원균의 종 복합체는 3종류이다(Dowling 등, 2020; Talhinhas와 Baroncelli, 2021). C. acutaum 종 복합체에 속한 종은 12종이고, C. gloeosporioides 종 복합체에 속한 종은 7종이며(C. fructicola, C. siamense, C. tropicale, C. alienum, C. theobromicola (syn. C. fragariae), C. aenigma, C. kahawae, C. gloeosporioides s. str.), C. boninense 종 복합체에 속한 종은 1종으로 브라질에서 보고한 C. karsti가 유일한 종이다(Dowling 등, 2020), 이와 같이 국외에서 발생하는 많은 종류의 사과 탄저병원균은 국내 유입 가능성이 있어 검역에서 관심을 가져야 할 병원균으로 생각한다.
C. gloeosporioides 종 복합체에 속한 종인 C. fructicola은 한국을 비롯한 7개국(USA, Korea, Brazil, Uruguay, Japan, France, China)에서 발생 보고가 있고, C. siamense는 한국을 비롯한 5개국(USA, Korea, Japan, Pakistan, Argentina)에서 발생 보고가 있다. 국제적으로 C. fructicola에 의한 병은 태국에서는 커피탄저병으로 보고되었고(Prihastuti 등, 2009), 일본은 돌배나무에 탄저병, 이스라엘은 갯질경이 탄저병, 미국은 사과, 복숭아 탄저병, 브라질은 사과 탄저병, 호주는 아보카도탄저병, 독일은 무화과나무, 아프리카 나이지리아에서는 마 탄저병으로 보고하고 있다(Weir 등, 2012).
C. acutaum 종 복합체에 속한 병원균 중 국제적으로 많이 발생하는 12종 중에서 국내 과수에서 발생하는 C. fioriniae는 전 세계적으로 7개국(USA, Belgium, Croatia, Japan, Korea, France, Slovenia)에서 발생 보고를 하고 있고, C. nymphaeae 은 한국을 비롯한 5개국(USA, Belgium, Brazil, Japan, Korea)에서만 발생 보고를 하고 있다(Dowling 등, 2020; Talhinhas 와 Baroncelli, 2021). 국내에서는 아직 사과에서 발생보고가 되지 않은 C. godetiae (syn. C. clavatum)는 일본을 비롯한 7개국(Belgium, UK, Netherlands, Slovenia, Japan, Croatia, Australia)에서 병 발생 보고를 하고 있어(Dowling 등, 2020; Talhinhas 와 Baroncelli, 2021), 앞으로 국내 유입 가능성이 있는 병원균으로 생각한다.
특히 한국과 기후가 유사한 미국 켄터기주에 사과탄저병은 C. gloeosporioides 종 복합체에 속한 종은 3개종(C. siamense, C. theobromicola, C. fructicola)과 C. acutaum 종 복합체에 속한 2개종(C. fioriniae, C. nymphaeae)을 보고하였는데(Munir 등, 2016), C. theobromicola는 아직까지 국내 발생보고가 없어 지속적인 관심 대상 종으로 생각한다. 최근까지 전 세계에서 발병 보고가 된 130종의 탄저병원균은 단일 국가에 발병 보고가 된 종은 지역적 고유종으로 구분하고 있다(Talhinhas와 Baroncelli, 2021). Lee와 Jung (2018)은 국내에 사과 잎에 반점병을 일으키는 Colletotrichum kakivorum은 신규 종으로 보고하였다. 이 종은 Dematium 종 복합체에 속한 종으로 Cannon 등(2012)이 처음 보고하였다. 이 종은 전 세계적으로 사과나무 잎에서 발병 보고가 없어 Talhinhas와 Baroncelli (2021)은 한국 고유종으로 구분하고 있다.
국내에서 사과 탄저병을 일으키는 5종의 병원균에 대한 병원성을 사과 3개 품종(홍로, 후지, 아오리)에서 상처 접종으로 조사한 결과에 의하면 C. siamense C. fructicola 및 acutatum 종 복합체의 C. fioriniae는 병원성이 강하여 병징이 크게 나타난 반면, C. nymphaeae와 C. gloeosporioides은 병원성이 약하였고, 사과에 상처를 내지 않은 병원균의 접종에서도 C. fructicola 가 발병률이 가장 높았다(Kim 등, 2020). Munir 등(2016)은 미국 켄터키주 과수원에 발생한 탄저병의 병징은 C. siamense가 C. fructicola에 의한 병징보다 병반이 더 크고, 병든 부분의 과실이 깊게 피해를 입는다.
복숭아 탄저병원균의 종 다양성
복숭아 탄저병원균의 종 다양성 조사는 재배 주산지인 경상북도 청도 5개면, 김천 2개면, 상주 3개면, 예천 3개면 및 영천 4개면의 과수원에서 품종별로 다양한 병징을 보이는 이병과를 채집하여 형태적 특징 과 6종의 유전자의 염기서열 분석으로 계통발생분석을 MEGA6, Maxium Likelihood method으로 동정하니, Table 2와 같이 gloeosporioides 종 복합체에 속한 2종과 acutatum 종 복합체 속한 1종은 최근까지 보고된 적이 없는 국내 미기록 종이었다(Lee 등, 2020b). Gloeosporioides 종 복합체에 속한 종은 C. siamense와 C. fructicola이고, acutatum 종 복합체에 속한 종은 C. fioriniae이었고(Lee 등, 2018), 이들 종은 형태적 특징과 분자생물적 특징, 병원성 및 살균제 감수성에 큰 차이를 보였다(Lee 등, 2020a).
국내 복숭아에 탄저병원균의 종 다양성 조사에서 한국식물병명목록((Korean Society of Plant Pathology, 2009)에 수록된 탄저병을 일으키는 병원균인 C. gloeosporioides와 C. acutatum 은 조사한 모든 복숭아 품종에서 분리 동정이 되지 않았다. 전체 채집한 샘플에서 병원균의 종 분리 비율은 acutatum 종 복합체에 속한 종인 C. fioriniae가 55%가 분리되어 복숭아 탄저병을 일으키는 우점 종이었고, 사과와는 달리 C. fructicola는 39%와 C. siamense는 약 5%만 분리 동정되었다(Lee 등, 2020b). 복숭아 품종별로는 병원균의 종 특이성을 보였다. 대홍 품종은 C. fructicola만 분리 동정되었고, 대옥계 품종(예천)은 C. fioriniae 만 분리 동정되었다. 천도 품종(영천)과 대월 품종(청도, 영천)은 C. fructicola와 C. fioriniae 모두 동정되었고, 무 모종인 천중도 품종(김천, 상주)은 C. siamense와 C. fioriniae가 분리 동정되어 품종에 대한 특이성을 보였다(Lee, 2019).
3종류의 병원균에 대한 병원성을 주요 재배 품종인 3품종(천중도, 대월, 대옥계)에서 상처접종으로 조사한 결과, C. fructicola가 C. siamense보다 병원성이 강하여 병징이 크게 나타난 반면, 병원성이 약하게 나타난 C. fioriniae와 C. siamense는 병징의 크기가 유사하였다(Lee, 2019). Hu 등(2015)은 C. fructicola의 병원성이 C. siamense보다 강하다고 보고하였다.
한국식물병명목록에는 복숭아 탄저병원균으로 유성세대 종명인 G. cingulate Spauld & H. Schrenk와 무성세대 종명인 C. gloeosporioides Penz. & Sacc = Gloeosporium lacticola Berk을 수록하고 있다. Kim과 Hong (2008)은 C. acutatum J. H. Simmonds에 의한 복숭아 탄저병의 발생을 보고하였다.
Dowling 등(2020)은 전 세계에서 복숭아 탄저병을 일으키는 병원균의 종 복합체는 3종류로 C. acutaum 종 복합체에 속한 3개 종(C. fioriniae, C. nymphaeae, C. simmondsii)과 C. gloeosporioides 종 복합체에 속한 2개 종(C. fructicola, C. siamense) 및 C. truncatum 종 복합체에 속한 1종(C. truncatum)이다. 2015년 이후 한국과 미국에서 복숭아 탄저병원균으로 보고한 종은 C. gloeosporioides 종 복합체에 속한 C. fructicola와 C. siamense이다(Hu 등, 2015; Lee, 2019). Hu 등(2015)은 미국 사우스캐롤라이나 주의 주요 복숭아 재배 지역의 많은 균주를 채집하여 다중 유전자 염기서열 분석으로 동정한 결과 그 전에 보고된 C. acutatum과 C. truncatum은 동정이 되지 않았고, C. fructicola 와 C. siamense만이 동정되었다고 보고를 하였다.
포도 탄저병원균의 종 다양성
포도 탄저병원균의 종 다양성 조사를 위한 이병과 샘플은 포도의 재배 주산지인 경상북도 상주시, 충북 영동군, 대구시의 과수원에서 품종별로 분리 동정한 종은 Table 2와 같이 gloeosporioides 종 복합체에 속한 3종(C. viniferum, C. aenigma, C. fructicola)이 있었고, acutatum 종 복합체에 종은 분리 동정이 되지 않았다. 4배체 품종인 거봉과 자홍에서 분리 동정한 병원균은 C. aenigma로 동정되어 지금까지 미보고 종으로 보고하였고(Kim 등, 2021), 샤인머스캣 품종에서는 C. fructicola가 동정되어 미보고 종으로 보고하였다(Lim 등, 2020). 캠벨어얼리 품종은 C. viniferum가 보고되었다(Oo와 Oh, 2017).
한국식물병명목록에는 포도 탄저병원균은 유성세대인 G. cingulate Spauld & H. Schrenk와 무성세대인 C. gloeosporioides Penz. & Sacc을 수록하고 있다(Korean Society of Plant Pathology, 2009). C. acutatum J. H. Simmonds에 의한 탄저병의 발생 보고가 있었지만(Hong 등, 2008), 이번 조사와 최근까지 보고에서도 국내에 포도 탄저병을 일으키는 병원균으로 C. acutatum은 보고되지 않았다.
전 세계적으로 포도에 탄저병을 일으키는 병원균의 종 복합체는 4종류이다(Dowling 등, 2020). C. acutaum 종 복합체에 속한 4종(C. fioriniae, C. nymphaeae, C. godetiae, C. citri)이 있고, C. gloeosporioides 종 복합체에 속한 7종(C. viniferum, C. gloeosporioides, C. fructicola, C. siamense, C. hebeiense, C. aenigma, C. clidemiae)이 있다. 그 외 C. truncatum 종 복합체에 속한 1종(C. truncatum)과 C. clivae 종 복합체에 속한 1종(C. clivae)이 있다(Dowling 등, 2020).
C. gloeosporioides 종 복합체에 속한 C. viniferum은 한국을 비롯한 3개국(Brazil, China, Korea)에서 병 발생 보고가 되었고, C. truncatum 종 복합체에 종인 C. truncatum은 브라질과 중국에서 발생 보고를 하였다(Dowling 등, 2020). Pan 등(2016)은 전세계적으로 유일하게 중국 광시 지역에서 포도의 탄저병을 일으킨 병원균으로 C. capsici을 보고하였고, C. truncatum에 의한 탄저병도 중국에서 발생 보고가 있었다(Dowling 등, 2020) C. capsici와 C. truncatum에 의한 포도 탄저병은 국내 유입에 관심을 가져야 할 것으로 생각한다.
감 탄저병원균의 종 다양성
감 탄저병원균의 종 다양성을 조사를 위해 홍시 용 감의 주산지인 경상북도 청도군의 5개면, 곶감 용 감 생산지인 상주, 영동, 예천 과수원에서 다양한 병징의 이병과를 채집하여 분리 동정한 결과, Table 2와 같이 병원균의 종류는 gloeosporioides 종 복합체에 속한 2종과 acutatum 종 복합체에 1종을 국내 미보고 종으로 보고하였고(Chang 등, 2018a; Hassan 등, 2019a; Jeon 등, 2017), 이들 병원균에 대한 종 다양성과 형태적 특징, 생리적인 특성 및 분자생물학적 유연관계를 분석하여 보고하였다(Hassan 등, 2018).
Gloeosporioides 종 복합체에 속한 종은 C. siamense와 C. horii이고, acutatum 종 복합체에 속한 종은 C. nymphaeae이었다. 기존에 국내 감 탄저병원균으로 보고된 C. gloeosporioides 은 분리 동정되지 않았다. Gloeosporioides 종 복합체에 속한 C. horii는 C. kahawae (커피탄저병)와 C. musea (바나나탄저병)의 종(분기군/계통군의 종)에서 유전적으로 먼 거리의 유연관계를 보이는 종이지만 C. musea분기군에 속한다(Hassan 등, 2018). Acutatum 종 복합체에 속한 종인 C. nymphaeae는 병반이 작고 여러 개의 검은 점을 형성하는 병징을 보인다(Hassan 등, 2019a). 포장에서 병원성이 강한 C. siamense는 C. horii보다 큰 병징을 보이며 병원성 시험에서도 동일한 결과를 볼 수 있었다(Hassan 등, 2018).
Weir와 Johnston (2010)은 기존에 보고된 Gloeosporium kaki Hori를 C. horii로 동정하여 신규 종(novel)으로 보고하였고, 국내에서는 단감에서 처음 보고되었다(Kwon 등, 2013).
한국식물병명목록에 수록된 감 탄저병을 일으키는 병원균은 유성세대인 Glomerella cingulate Spauld & H. Schrenk 와 무성세대인 C. gloeosporioides Penz. & Sacc = Gloeosporium kaki S. Ito)로 기록되어 있다. 감 탄저병은 1958년 충남대학교 농과대학 연구보고 제1호(박종성)와 1985년 경북대농학지(김지영 와 이준탁)에 보고되었다(Korean Society of Plant Pathology, 2009).
자두 탄저병원균의 종 다양성
자두의 탄저병원균의 종 다양성 조사는 주산지인 경상북도 상주시, 김천시, 군위군, 경산시의 과수원에서 다양한 병징을 보이는 이병과를 채집하여 형태적 특징과 다중 유전자의 염기서열을 분석하여 동정한 종은 Table 2와 같이 gloeosporioides 종 복합체에 속한 2종(C. gloeosporioides, C. siamense)과 acutatum 종 복합체의 속한 2종(C. fioriniae, C. nymphaeae)이었고, C. gloeosporioides을 제외한 3종은 국내 미 보고 종으로 보고하였다(Chang 등, 2018b), 이들 종에 대한 형태적 특징과 분자생물학적 특징 및 병원성에 큰 차이가 있었다(Hassan 등, 2019a).
국내에 발생하는 C. gloeosporioides 종 복합체에 속한 2종과 acutatum 종 복합체에 속한 2종에 대한 병원성을 조사하니 C. siamense가 병원성이 가장 크고, C. nymphaeae는 가장 약하였다(Hassan 등, 2019b). 한국식물병명목록는 자두 탄저병을 수록하지 않고 있다(Korean Society of Plant Pathology, 2009).
대추 탄저병원균의 종 다양성
대추 탄저병원균의 다양성 조사를 위해 대추 재배 주산지인 충청북도 보은군 2개면, 경북 경산군 5개면의 과수원에서 다양한 병징을 보이는 이병과를 채집하여 병원균을 분리하여 형태적특징과 다중 유전자의 염기서열을 분석하여 동정한 병원균의 종은 Table 2와 같이 gloeosporioides 종 복합체에 속한 종인 C. gloeosporioides와 acutatum 종 복합체에 속한 종인 C. nymphaeae로, 이 중 C. nymphaeae는 국내 미보고 종이었다(Kang 등, 2023).
대추의 재배 품종은 충북 보은 지역의 전체 재배 품종은 재래종인 보은 대추에서 분리 31개 균주가 모두 C. nymphaeae 로 동정되었고, 경북 경산 지역의 재배품종은 개량종인 복조 품종에서 분리 동정한 50개 균주는 모두 C. gloeosporioides로 동정되어 대추 품종 간에 병원균의 종 특이성을 보였다(Kang, 2021). 두 종류의 병원균의 병원성은 포장에서의 증상과 실내 병원성 접종 실험에서 동일하게 C. gloeosporioides의 병원성이 C. nymphaeae보다 강하고 병징도 크다(Kang, 2021). 전 세계적으로 대추 탄저병에 대한 보고가 거의 없으며, 최근 중국에서 C. siamense에 의한 탄저병 발생 보고가 있다(Han 등, 2023).
호두나무 탄저병
호두나무 탄저병은 경북과 천안지역에서 탄저병 증상을 보이는 잎, 줄기 및 과실을 채집하여 형태적 특징과 유전자 다중분석으로 동정한 종은 Table 2와 같이 acutatum 종 복합체에 속한 종인 C. orientalis를 동정하여 국내 미보고 종으로 보고하였다(Jang 등, 2023). 호두 탄저병은 잎, 줄기 및 과실에서 동일 종이 병을 일으킨다. 병원균의 형태적인 특징과 다중 유전자의 염기서열을 분석하여 계통발생수로 병원균의 종간의 유연관계와 종 동정을 하였다.
C. orientalis은 호두에 탄저병을 일으키는 종으로 신규 종으로 보고하였다(Laura 등, 2022). C. orientalis은 전 세계 단일 종으로 보고한 C. fioriniae (Damm 등, 2012a)에서 분화된 새로운 종이고, 사과에도 탄저병을 일으킨다고 보고하였다(Chen 등, 2022). 국내 여러 지역의 과수원에서 호두 탄저병의 증상에서 분리 동정한 병원균은 1종인 C. orientalis이고, 과실의 병 증상은 병든 열매의 표피가 검은색으로 여러 방향으로 갈라지는 특이적인 증상으로 일반적인 탄저병 증상과는 차이를 보였다(Jang 등, 2023).
살균제에 대한 탄저병원균의 감수성 반응
사과 탄저병원균의 살균제의 감수성.
사과에 탄저병을 일으키는 5종의 병원균(C. siamense, C. fructicola, C. gloeosporioides, C. fioriniae, C. nymphaeae)에 대한 계통이 다른 4종류의 살균제에 대하여 감수성을 조사한 EC50값은 Table 3과 같다. 4종류의 살균제인 QoI/Strobilurin 구룹에 azoxystrobin WP (권장살포 농도: 109 μg/ml), methyl benzimidazole carbamate (MBC)/carbamate 그룹에 carbendazim WP (권장살포 농도: 600 μg/ml), MBC 그룹에 thiophanate-methyl WP (권장살포 농도: 700 μg/ml) 및 demethylation inhibitor/triazole 그룹에 tebuconazole WP (권장살포 농도: 125 μg/ml)에 대한 50% 균총의 생장을 억제하는 EC50값은 살균제의 종류별 병원균의 종 간에 큰 차이의 감수성이 있다(Kim 등, 2020).

EC50 value of fungicides to the mycelial growth of Colletotrichum species collected from fruit in Korea
Tebuconazole에 대한 5종의 병원균의 EC50값은 C. nymphaeae이 0.12 μg/ml로 가장 낮았고, C. siamense가 2.1 μg/ml로 가장 높아 종 간에 큰 차이를 보였고, 지역별 선발한 34개균주 중 EC50값이 1.5–3.5 μg/ml 범위에 속한 균주가 50%가 넘어 이 약제에 대하여 감수성이 가장낮은 병원균이었다. C. fructicola 균주는 tebuconazole에는 C. siamense보다 상대적으로 낮은 EC50값(0.8 μg/ml)을 보였지만, 그 외 azoxystrobin (EC50: 55.7 μg/ml), carbendazim (EC50: 150 μg/ml) 및 thiophanate-methyl (EC50: 204.6 μg/ml)에는 가장 높은 EC50값을 보여 이들 3종류의 약제에는 가장 감수성이 가장 낮은 병원균이다. Carbendazim 에 대한 C. fructicola의 66균주의 EC50값의 범위는 0.01–576.7 μg/ml이었고, 권장살포농도인 600 μg/ml 이상의 EC50값을 보인 균주는 46개이고, thiophanate-methyl의 EC50값의 범위는 0.1–571.4 μg/ml이었고, 권장살포농도인 700 μg/ml 이상의 EC50값을 보인 균주는 38개로 저항성 균주일 가능성이 높다. OoI 계통의 azoxystrobin 살균제에 대한 EC50값은 C. furcticola 균주(55.7 μg/ml)와 C. gloeosporioides 균주(36.3 μg/ml)가 감수성이 낮은 반면, C. fioriniae 균주와 C. nymphaeae 균주의 EC50값은 0.14와 0.06 μg/ml로 감수성이 높았다. C. siamense 균주는 tebuconazole을 제외한, 다른 3종류의 살균제에서는 다른 병원균에 비해 상대적으로 낮은 EC50값을 보였다.
Azoxystrobin의 권장 살포 농도(109 μg/ml)에서 5종류의 병원균은 최저 83%에서 최고 100%까지 균총이 생장함으로서 포장에서의 병 방제 효과에 대한 면밀한 검토가 필요할 것으로 생각되면, 특히 azoxystrobin, carbendazim 및 thiophanate-methyl에 대하여 감수성이 가장 낮은 C. fructicola 균주는 채집한 균주 중 가장 많은 비율로 분리 동정되었음으로 병 방제를 위한 살균제의 사용에 있어서 지역별, 품종별 주요 병원균에 의한 병 발생에 따라서 방제 효과에 큰 차이를 보일 것으로 생각됨으로 더 많은 구체적인 연구가 필요할 것으로 생각된다(Kim, 2019).
사과탄저병을 일으키는 병원균으로 포장에서 가장 많이 분리 동정되는 C. fructicola와 C. siamense 작용 기작이 다른 4종류의 살균제에 대한 감수성에 차이가 있다. C. siamense은 tebuconazole에서 감수성이 가장 낮았고, C. fructicola 그 외 3종류의 살균제에서 감수성이 가장 낮아 병원균의 종류별, 살균제의 종류와 살균제의 노출 정도에 따라서 유전자에 변이가 생겨 저항성 병원균이 유발되지 않았나 생각됨으로 지역별 병원균에 대한 살균제의 저항성 모니터링과 보다 심층적으로 저항성 기작 연구로 병 방제를 위한 살균제 사용에 대한 대안 제시가 필요할 것으로 생각한다.
복숭아 탄저병원균의 살균제의 감수성.
복숭아 탄저병의 방제 약제로 등록된 살균제인 tebuconazole SC (20%)과 thio-phanate-methyl WP (70%)에 대하여 50% 균사 생장을 억제하는 EC50값은 살균제의 종류 별 병원균의 종 간에 살균제의 감수성은 Table 3과 같이 큰 차이를 보인다(Lee 등, 2020b). Tebuconazole은 C. fioriniae의 균주에 대한 평균 EC50값은 0.1 μg/ml, C. siamense 균주의 EC50값은 0.7 μg/ml 및 C. fructicola 균주의 EC50값은 0.3 μg/ml로 종 간에 감수성 차이가 적었다. 하지만, thiophanate-methyl에 대한 C. fioriniae 균주의 EC50값은 7.2 μg/ml, C. siamense 균주의 EC50값은 0.1 μg/ml 및 C. fructicola 균주의 EC50값은 354.4 μg/ml로 종 간의 감수성에 큰 차이를 보였다. 특히 C. fructicola 균주는 thiophanate-methyl에 대한 가장 높은 EC50값을 보여 감수성이 가장 낮았다. 두 살균제의 권장 살포 농도(thiophanate-methyl: 700 μg/ml, tebuconazole: 100 μg/ml)에서 병원균의 종류별 전체 균주의 균총이 생장하는 비율은 thiophanate-methyl에서 C. fioriniae는 전체 55균주 중 56%가 생장하였고, C. fructicola는 전체 39균주 중 95%가 균총이 생장하여 살균제의 감수성이 크게 낮은 반면, 병원균의 분리 동정 비율이 낮은 C. siamense는 생장하지 못하여 높은 감수성을 보였다. Tebuconazole 권장살포농도(100 μg/ml)에서는 3종의 병원균의 균주가 모두 생장하지 못하여 감수성이 높았지만, 병원균의 종 간에는 차이를 보였지만, C. siamense 균주의 경우, 3종류의 병원균 중 가장 EC50값이 높았다. 그러나 사과에서 분리 동정한 동일 종에 비해 EC50값은 상대적으로 낮았지만 유사한 결과를 보인 것은 포장에서 살균제의 노출 정도의 차이로 보임으로 더 많은 연구가 필요할 것으로 생각된다. 특히 C. fructicola의 경우, 사과에서 분리 동정한 C. fructicola 균주도 thiophanate-methyl에서는 80% 이상 균총이 생장하고, 높은 EC50값을 보여 복숭아에서 분리 동정한 균주와 유사한 결과를 보임으로서 포장에서의 병 방제 효과가 낮을 것으로 생각됨으로 다양하게 더 많은 연구가 필요할 것으로 생각한다.
포도 탄저병원균의 살균제의 감수성.
포도 탄저병 방제용 살균제인 azoxystrobin, carbendazim 및 tebuconazole에 대한 C. fructicola, C. aenigma 및 C. viniferum의 균주에 대한 감수성은 약제의 종류별로 Table 3과 같이 큰 차이를 보인다. C. fructicola 균주는 azoxystrobin에 대한 EC50값이 110.28 μg/ml로 C. aenigma 균주의 61.52 μg/ml와 C. viniferum 균주의 28.21 μg/ml에 비하여 현저하게 감수성이 낮은 것을 볼 수 있다. Carben-dazim에 대한 C. aenigma 균주의 EC50값은 가장 높은 256.83 μg/ml이었고, C. fructicola 균주는 214.75 μg/ml로 감수성이 낮은 반면, C. viniferum 균주는 0.05 μg/ml로 가장 감수성이 높아 병원균의 종 간에 큰 차이를 보였다. Tebuconazole에 대한 병원균의 종 간에 감수성은 1.07–1.85 μg/ml로 상대적으로 감수성의 차이를 보였다(Kim 등, 2023).
Azoxystrobin에 대한 C. fructicola 균주의 EC50값은 다른 2종의 병원균보다 높아 종 간에 감수성이 가장 낮았다. 이는 다른 과실에서 채집하여 분리 동정한 동일한 C. fructicola 균주에서도 유사한 경향을 보여 이 약제에 대한 저항성이 나타난 균주로 생각된다. 반면 tebuconazole에 대한 EC50값은 다른 과실에서 분리 동정한 동일 종 간에는 감수성의 차이가 상대적으로 크지 않고 유사한 경향을 보여 살균제 종류별로 병원균의 종 간에 감수성 차이가 크다는 것을 알 수 있다. 살균제의 종류별로 병원균에 대한 감수성의 큰 차이를 보이는 것으로 보아 앞으로 다양한 연구를 통하여 약제 저항성을 보이는 병원균의 종에 대한 심층 조사를 통해 병 방제 효과를 높일 수 있는 대안 제시가 필요할 것으로 생각된다.
감 탄저병원균의 살균제의 감수성.
감에 탄저병을 일으키는 2종류의 주요 병원균은 C. siamense와 C. horii에 대하여 탄저병 방제용으로 등록된 dithianon, tebuconazole 와 thio-phanate-methyl에 대하여 EC50값은 병원균의 종류 간에 뚜렷한 감수성의 차이는 Table 3과 같이 크다(Jeon, 2017).
청도 반시 품종(홍시용감)에서 탄저병원균인 C. siamense 균주는 3종류의 살균제 대하여 둥시 품종(꽂감용) 탄저병원균인 C. horii 균주보다 EC50값이 크게 높아 감수성이 낮았다. 3종류의 살균제 중 dithianon에서 2종의 병원균 모두가 EC50값이 높아, 살균제의 감수성이 가장 낮았다. C. siamense 균주의 EC50값은 318.9 μg/ml인 반면, C. horii 균주의 EC50값은 89.9 μg/ml로 크게 낮아 감수성에 큰 차이를 보였다. Tebuconazole의 EC50값은 C. siamense 균주는 1.41 μg/ml이고, C. horii 균주는 0.014 μg/ml로 10배 이상의 큰 감수성에 차이가 있고, thiophanate-methyl은 C. siamense 균주는 1.42 μg/ml이고, C. horii 균주는 0.53 μg/ml로 감수성이 차이를 보였다. 살균제의 종류에 따른 병원균의 종간의 감수성의 차이는 각각 재배 품종별 탄저병을 일으키는 병원균의 종이 다르고, 재배 중 살균제의 사용에 따른 노출 빈도에 기인한것으로 생각된다.
감 탄저병 방제용 약제 중 tebuconazole에 대하여 C. siamense 균주의 EC50값은 높은 것은 다른 과수류에 분리 동정한 동일 종과 유사한 결과이지만, thiophanate-methyl에 대한 C. siamense 균주의 EC50값이 낮은 것은 약제의 노출 정도에 차이로 생각되지만 추가적인 연구가 더 필요할 것으로 생각된다.
대추 탄저병원균의 살균제의 감수성.
대추에 탄저병을 일으키는 C. gloeosporioides와 C. nymphaeae에 대하여 탄저병 방제 약제 등록된 tebuconazole, carbendazim 및 azoxystrobin 에 대한 감수성 반응을 균사 생장을 50% 억제하는 EC50값을 조사한 결과, Table 3과 같이 살균제 종류별로 병원균의 종류에 따라서 감수성의 차이가 있다(Kang 등, 2023). 계통이 다른 3종류의 살균제에 대하여 C. gloeosporioides 균주는 C. nymphaeae 균주보다 EC50값이 높아 균총 생장이 높은 농도에서 억제되어 감수성이 낮았다. Tebuconazole에 대한 C. gloeosporioides 균주의 EC50값 0.91 μg/ml로 C. nymphaeae 균주의 EC50값이 0.36 μg/ml보다 2배 이상 높아 감수성이 낮았다. Carbendazim 에 대한 EC50값도 C. gloeosporioides 균주는 14.77 μg/ml이고, C. nymphaeae 균주는 1.44 μg/ml로 감수성에 큰 차이를 보인다. Azoxystrobin에 대한 EC50값도 C. gloeosporioides 균주는 0.25 μg/ml인 반면, C. nymphaeae 균주는 0.05 μg/ml로 낮아 감수성에 차이를 보였다(Kang, 2021). 계통이 다른 3종류의 살균제에 대한 2종류의 병원균의 균주수 각각 20개로 무작위 선발하여 감수성 기준 농도인 EC50값을 조사하니 약제의 종류에 따라서 차이가 있다. Tebuconazole은 감수성 기준 농도(EC50)는 0.64 μg/ml이고, carbendazim은 8.11 μg/ml 및 azoxystrobin 은 0.15 μg/ml이다. C. gloeosporioides 균주는 3종의 살균제에서 C. nymphaeae 균주보다는 감수성이 크게 낮아 포장에서 병 방제 효과에도 영향을 미칠 것으로 생각한다.
오미자 탄저병원균의 살균제의 감수성.
오미자(Schisandra)의 탄저병원균은 C. gloeosporioides와 C. fioriniae로 이들 균주로 오미자에 등록된 약제 중 계통이 다른 fludioxonil과 pyraclostrobin 살균제에 대한 EC50값은 두 종 간에 큰 차이를 보였다(Table 3). C. gloeosporioides 균주는 2종류의 약제에서 감수성이 C. fioriniae 균주보다 현저히 낮았다. C. gloeosporioides 균주는 fludioxonil과 pyraclostrobin에 대한 EC50값은 각각 10.5 μg/ml와 5.35 μg/ml으로 높은 반면, C. fioriniae 균주의 EC50값은 각각 0.55 μg/ml와 0.97 μg/ml로 낮아 약제에 대한 감수성이 높아 이 병원균에 의해 발생한 탄저병은 포장에서도 병 방제 효과가 높을 것으로 보인다.
결 언
국내 과수류의 과실에 탄저병을 일으키는 병원균의 종류는 다양하고, 과수의 종류마다 병원균의 종 다양성도 다르다. 전세계적으로 과수에 탄저병을 일으키는 종은 지역적으로 다양하여 국내에 병원균의 종보다 많은 종에 의해 발병되고 있다. 탄저병원균의 유전적인 특성과 생물학적 특성은 다른 식물병원균보다 복잡하고 다양하여 과거에 동일 종으로 다양하게 보고되었던 종들이 염기서열에 기반한 계통발생분석을 통해 동정한 결과, 기존에 전 세계에서 한종으로 보고된 종들은 동일한 종이 아닌 다수 종으로 동정되어 종 복합체로 보고하고 있다. 최근까지 탄저병원균은 15개 종 복합체가 보고되었고, 이들 종 복합체 안에 포함된 많은 종류의 탄저병원균은 지역적으로 발생이 다양하며, 특히 아시아에서 중국이 가장 많은 병 발생을 보고하고 있다. 이와 같이 많은 종 들이 다양한 과수류에서 발병하고 있어 올바르게 종을 동정하여 보고하는 것이 국가차원의 검역에도 도움을 줄 수 있을 것이다. 감귤에서 탄저병원균이 처음 보고된 이후 100년 이상이 지나면서 여러 번 분류 체계를 만들어 왔지만, 형태적으로도 다양한 탄저병원균의 종을 형태적인 특징에만 의한 종 동정에는 한계가 있었다. 염기서열 분석에 의한 계통발생분석에 의한 종 동정은 형태적인 특징에 의한 종을 동정하는 데 한계를 극복하는 도구로 사용되고 있다. 국제적으로 많은 종 동정 방법으로 제시된 구체적인 방법으로 5종 이상의 다중 유전자의 염기서열을 분석한 자료를 병합하여 병원균의 계통발생분석으로 동정하는 방법과 형태적인 특징을 함께 사용하는 방법이 탄저병원균의 종 동정을 위한 확립된 방법으로 제시되고 있다.
국내 과수류의 과실 탄저병을 일으키는 병원균의 종은 제한적으로 몇 종만이 보고되어 왔다. 2012년 이후 보고된 탄저병원균에 대한 국제적인 동정 방법에 준하여 국내 과수류에 발생하는 탄저병원균을 채집하여 재동정한 결과, C. gloeosporioides 이 외에 여러 종이 국내에서 전혀 보고되지 않은 다양한 미보고 종으로 보고되고 있다. 최근까지 과실에 탄저병을 일으키는 국내 미보고 종은 모두 6종으로 C. gloeosporioides와 C. acutatum 종 복합체에 속한 각각 3종이다. 특히 형태적인 특징만으로 국내 과실의 탄저병원균으로 보고한 C. acutatum은 다중유전자 분석에 의하여 종 동정으로는 국내 과실에 탄저병을 일으키는 병원균으로 보고가 되지 않은 종이다. 사과에 탄저병에 주요병원균인 C. fructicola는 포도, 복숭아에 병을 일으키고, C. siamense는 사과, 복숭아, 감, 자두와 고추 등에서 병을 일으키고, C. gloeosporioides 사과, 자두, 대추에 병을 일으킨다. C. fioriniae와 C. nymphaeae는 사과, 자두, 감에서 발병하고 있다. 이들 병원균은 다른 작물에서도 발병하고 있고, 앞으로도 발병할 수 있는 병원균으로 관심 대상으로 생각한다. 특정 종은 감과 대추와 복숭아에서 품종 특이적으로 병을 일으키기도 한다. 이들 병원균에 의해 발생하는 과수류의 탄저병은 매년 기후조건에 따라 피해가 증감되고 있다. 과수류의 종류별 탄저병 방제를 위한 살균제는 많은 종류가 등록이 되어 있어 계통이 다른 살균제에 대한 우리 연구팀에서는 수년간 과수의 종류 별로 다양한 종의 탄저병원균에 대한 실내에서 균사생장을 50% 억제하는 EC50값으로 감수성을 평가하니 다양한 결과가 나타났다. 이 결과는 포장에서의 실증시험이 반드시 필요한 근거를 제공한 것으로 지역별 병 발생의 차이와 환경조건에 따라 포장에서 병 방제 효과를 검증하는 것이 필요하다고 본다. 특정 살균제의 경우 포장에서 권장 사용 농도의 살균제 혼용 PDA 배지에서 분리 동정한 균주의 80% 이상의 균총이 생장한다는 것은 해당 병원균의 종이 살균제의 효과가 없거나 저항성이 유발되었을 것으로 생각됨으로 특정 살균제와 다양한 탄저병원균의 종에 대한 구체적인 저항성 연구를 기반으로 평가가 이루어져야 할 것으로 생각된다. 본 리뷰는 국내 발생하는 다양한 기주 식물에서 탄저병원균을 분리하여 국제적인 방법에 준하여 정확하게 종을 동정하는 것이 수입농산물의 검역도 필요하다고 본다. 또한 다양한 종류의 탄저병원균에 대한 살균제의 종류별로 다양한 저항성 평가가 필요하다. 과수류의 종류에 따라 특정 살균제에 대한 감수성과 저항성 평가는 실내와 실외에서 지역별로 실시하여 병 방제효과가 떨어지는 살균제에 대한 사용가능 여부에 대한 구체적인 대안을 제시하는 것이 효과적인 병 방제에 도움이 될 것으로 생각된다.
Notes
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.
Acknowledgments
We would like to thank all the members of the Plant Pathology Lab, School of Ecology Environmental System, Kyungpook National University, Sangju, Gyeongbuk 37224, Korea (Republic of) for their help conducting the experiments.