배추 품종들의 검은썩음병에 대한 저항성 특성
Resistance Characteristics of Chinese Cabbage Cultivars to Black Rot
Article information
Abstract
Xanthomonas campestris pv. campestris (Xcc)에 의한 검은썩음병은 배추 재배에서 가장 심각한 피해를 입히는 병해 중 하나이다. 본 연구는 Xcc에 대한 배추의 저항성 특성을 조사하기 위하여 실험하였다. 먼저, Xcc 8개 균주의 병원력을 비교하기 위하여, 감수성인 배추 4개 품종에서 이들 균주에 의한 배추 검은썩음병 발생을 조사하였다. 실험에 사용한 Xcc 균주들은 균주들 간에 서로 다른 병원력을 보였다. 그리고 Xcc에 대한 저항성 및 중도저항성 22개 배추 품종을 선발하고, Xcc 8개 균주를 사용하여 이들 배추 품종의 검은썩음병 발생을 조사한 결과, 배추 품종들의 평균 검은썩음병 병반면적률은 Xcc 균주들의 병원력에 따라 증가하였다. 게다가 실험한 각 배추 품종들의 검은썩음병 발생은 실험한 균주들의 병원력에 비례하여 증가하였으며, Xcc 균주들에 대해 저항성인 배추 품종의 수는 균주들의 병원력에 반비례하게 감소하였다. 이상의 결과로부터 Xcc에 대한 배추의 저항성은, 병원균의 레이스 분화가 아니라 병원균의 병원력에 영향받는다고 생각되었다.
Trans Abstract
Black rot of Chinese cabbage caused by Xanthomonas campestris pv. campestris (Xcc) is one of the most severe diseases in crop cultivation. To define the resistance characteristics of Chinese cabbage to Xcc, we tested the virulence of eight Xcc isolates in four susceptible cultivars of Chinese cabbage. The isolates of Xcc showed different the virulence on the cultivars. On the other hand, we selected 22 resistant or moderately resistant cultivars of Chinese cabbage to Xcc and tested the occurrence of black rot on the cultivars caused by the isolates of Xcc. Mean disease severity of black rot on the Chinese cabbage caused by each isolate was also positively correlated with the virulence of Xcc isolates. Furthermore, the development of black rot in each cultivar increased according to virulence of Xcc isolates. The number of resistant cultivars of Chinese cabbage to eight isolates of Xcc decreased according to the virulence increase of bacteria. Taken together, these results suggest that resistance of Chinese cabbage cultivars to Xcc is likely affected by the virulence of Xcc isolates, but not result from race differentiation.
서 론
우리나라에서 배추(Brassica rapa ssp. pekinensis)의 재배는 작형이 세분화되어 연중 재배가 가능하게 되었고, 이에 따라 연작 재배지가 증가함에 따라 다양한 식물병이 발생하고 있다(Korean Society of Plant Pathology, 2022). 특히, 기후 변화와 더불어 세균병의 발생이 크게 증가하고 있다. Xanthomonas campestris pv. campestris (Xcc)에 의해 발생하는 배추과 작물의 검은썩음병 (black rot)은 평균 기온이 25–30°C인 다습한 지역에서 재배하는 배추, 양배추, 꽃양배추, 콜라비, 무 등에 심하게 발생하여 경제적으로 큰 손실을 주고 있다(Jorgensen과 Walter, 1955; Williams, 1980). 그람 음성 식물병원세균인 Xcc는 주로 종자 전염하는데, 감염된 식물 및 이병 잔재물 등을 통해 감염시키기도 한다. Xcc는 이병 종자에서는 3년, 토양에서는 20–40일 생존이 가능하다(Clayton, 1924; Cook 등, 1952; Dane과 Shaw, 1996; Schaad와 Alvarez, 1993; Schaad와 White, 1974; Walker, 1941, 1953). 하지만 토양에서 세균만으로 존재하는 것보다 이병식물 잔재물에 있을 때 더 오래 생존할 수 있다(Arias 등, 2000). Xcc는 빗방울과 바람, 물에 의해 전반 되고, 일반적으로 잎 가장자리의 수공을 통해 식물체 내부로 침입하고 물관을 통해 이동한다(Cook 등, 1952; Russell, 1898; Vincente와 Holub, 2013).
배추의 검은썩음병을 방제하기 위한 방법으로 종자를 물리화학적인 처리를 하여 제조한 건전 종자의 재배(Gangopadhyay와 Gill, 1977; Kishun, 1984; McKeen, 1981; Schaad와 Alvarez, 1993; Schultz와 Gabrielson, 1986), 비기주 작물과의 윤작, 보르도액과 항생제 등을 이용한 화학적 방제(Bhat 등, 2000; Gupta, 1991; Knosel, 1965; Onsando, 1988) 그리고 길항미생물 및 박테리오파지를 이용한 생물학적 방제(Jalali와 Parashar, 1995; Pichard와 Thouvenot, 1999; Wulff 등, 2002) 등이 사용되고 있으나, 지구온난화 등으로 인하여 세균병인 배추의 검은썩음병 발생이 크게 증가하고 있어 이들 방제 방법은 효과적이지 못한 실정이다.
오늘날 저항성 품종을 재배하는 것은 친환경적이며, 특히 세균병 방제에 있어서는 가장 효과적인 방제방법으로 인식되고 있다(Taylor 등, 2002; Vijeth 등, 2018; Yerasu 등, 2019). 우리나라에서 검은썩음병에 대한 저항성으로 판매하고 있는 배추 품종은 거의 없다. 저항성 품종을 개발하기 위해서는 저항성 유전자원의 선발 그리고 저항성 유전자원과의 교배 및 여교배를 통해 얻은 종자들 중 저항성 개체를 효과적으로 선발하는 것 즉 효율적인 병리검정이 이루어져야 한다.
저항성 품종을 개발하기 위한 병리검정은 작물의 병 저항성에 대한 병원균의 레이스 분화 여부를 조사하는 것이 반드시 필요하다. 왜냐하면 작물의 저항성이 작물의 병 저항성과 관련된 병원균의 레이스 분화가 있는 질적 저항성(qualitative resistance)인지 혹은 병 저항성에 대한 병원균의 레이스 분화가 없는 양적 저항성(quantitative resistance)인지에 따라 병 저항성 품종 개발을 위한 병리검정 방법을 다르게 해야 하기 때문이다. 그리고 포장에서 저항성 품종을 이용하여 식물병을 효과적으로 방제하기 위해서도 반드시 병 저항성에 연동된 병원균의 레이스 분화 연구가 필요하다.
병 저항성과 관련된 식물병원균의 레이스 분화는 기주 식물의 저항성이 질적 저항성인 경우에 일어난다. 예를 들면, 멜론의 덩굴쪼김병 저항성은 Fom-1과 Fom-2 유전자에 의해 결정되며, 이에 따라 병원균 F. oxysporum f. sp. melonis는 두 저항성이 없는 경우에만 감염할 수 있는 레이스 0, Fom-1 유전자가 도입된 멜론을 감염할 수 있는 레이스 1, Fom-2를 감염할 수 있는 레이스 2, 두 저항성 유전자 모두가 도입된 멜론을 감염할 수 있는 레이스 1, 2로 구분된다(Risser 등, 1976). 이외에도 고추의 세균점무늬병균(Xanthomonas euvesicatoria)에 대한 저항성(Hibberd 등, 1987), 배추의 뿌리혹병균(Plasmodiophora brassicae)에 대한 저항성(Hirai, 2006; James와 Williams, 1980; Kuginuki 등, 1999; Yoshikawa, 1983, 1993), 양배추의 시들음병균(Fusarium oxysporum f. sp. conglutinans)에 대한 저항성 (Ramirez-Villupadua 등, 1985) 그리고 토마토의 잎곰팡이병균(Fulvia fulva)에 대한 저항성(Enya 등, 2009; Takken 등, 1998)도 질적 저항성을 하며 기주의 저항성 유전자에 대한 병원균의 반응에 따른 레이스 분화가 알려져 있다. 배추의 검은썩음병균인 Xcc의 경우에는 Vicente 등(2001, 2002)은 Xcc 균주들을 B. rapa, B. oleracea, B. juncea, B. napus 등에 존재하는 질적 저항성 병 저항성 유전자와 관련하여 6개의 레이스로 구분하는 방법을 보고하였습니다. 하지만 우리나라에서 시판되고 있는 배추 품종에 대한 검은썩음병균의 레이스 분화 여부에 대한 연구는 보고되지 않았다.
따라서 본 연구에서는 실험에 사용하는 Xcc 8개 균주들의 병원력(virulence)을 조사하고, 그리고 Lee 등(2020a)의 결과로부터 저항성 반응을 나타내거나 종자회사에서 저항성으로 판매하고 있는 배추 품종 20개를 선발하여, 이들 배추 품종에서의 Xcc 8개 균주에 의한 검은썩음병 발생을 조사하고, 실험한 균주들에 대한 이들 품종의 저항성 정도를 비교 분석하여 레이스 분화 여부를 추정하였다.
재료 및 방법
식물 재배
배추의 검은썩음병균인 Xcc 8개 균주의 병원력 차이를 조사하기 위해서는 Lee 등(2020a)의 결과를 바탕으로 검은썩음병균에 감수성인 배추 품종 4개(‘ CR 농심’[Syngenta Korea, Seoul, Korea], ‘춘광’[Sakata Korea, Seoul, Korea], ‘ CR 하루요시’[Takii Korea, Seoul, Korea], ‘춘연’[Asia Seed, Seoul, Korea])를 시중에서 구입하여 실험에 사용하였다. 그리고 Lee 등(2020a)의 결과를 바탕으로 Xcc KACC 10377에 대한 저항성 및 중도저항성인 배추 품종들의 Xcc 8개 균주에 대한 검은썩음병 저항성 정도를 조사하기 위해서는, 시판 중인 배추 20개 품종(신젠타종묘로부터 ‘ CR 안심’과 ‘ CR 진심’을, 몬산토코리아로부터 ‘강력여름’, ‘노랑김장’, ‘노랑김치’, ‘노랑추석’, ‘삼보엇갈이’, ‘진청’, ‘참이슬엇갈이’ 및 ‘챔피온’, 농우바이오로부터 ‘금방울’, ‘대통’, ‘뚝심엇갈이’, ‘산울림’ 및 ‘월동천하’, 코레곤종묘에서 ‘ CR 요시마사’, 현대종묘로부터 ‘씨알제왕’, 사카타코리아로부터 ‘노랑맛하장’, 아시아종묘로부터 ‘장생3호’와 ‘만수무강’)을 구입하여 실험에 사용하였다. 이 때 감수성 대조 품종으로 ‘춘광’, ‘ CR 하루요시’ 및 ‘춘연’도 함께 실험하였다.
배추의 검은썩음병 발생 실험에 사용한 식물체는 5×8 육묘용 연결포트(70 ml/pot, Bumnong, Jeongup, Korea)에 원예용상토 2호(Punong, Gyeongju, Korea)를 넣고, 배추 종자를 포트당 1립씩 파종한 뒤 온실(25±5°C)에서 재배하였고 파종 10일 후에 2엽이 전개된 배추 유묘를 사용하였다.
사용 균주
배추검은썩음병균 Xcc 균주는 농촌진흥청 농업유전자원센터(Korean Agricultural Culture Collection [KACC], Rural Development Administration, Jeonju, Korea)로부터 KACC 10377, KACC 17966, KACC 19132, KACC 19133, KACC 19134, KACC 19135, KACC 19136 및 KACC 19527 균주를 분양 받아 실험에 사용하였다. Xcc 균주들은 멸균한 20% glycerol에 넣고 –75°C deep freezer에 저장해두고 하나씩 꺼내어 실험에 사용하였다.
접종원 준비
Xcc 균주들은 Petri dish (직경 8.5 cm)에 준비한 tryptic soy agar (TSA; Becton, Dickinson and Co., Sparks, MD, USA) 배지에 각 균주를 도말하여 접종하고 30°C에서 1일간 전배양하고, 이를 새로운 TSA 배지에 다시 평판도말하여 30°C에서 2일간 배양하였다. Xcc 균주를 배양한 배지에 멸균수를 5 ml 넣고 병원균을 수확하고, 여기에 멸균수를 넣고 잘 흔들어 현탁한 후에 UV spectrophotometer (Beckman Coulter Inc., Brea, CA, USA)를 사용하여 흡광도(optical density, OD)를 측정하였다. 멸균수를 이용하여 세균 현탁액의 농도를 OD600=0.175 (1.0×108 cfu/ml)가 되도록 조정한 뒤 접종원으로 사용하였다.
병원균 접종 및 발병
배추 유묘의 검은썩음병 발생을 위해서는 준비한 각 Xcc 균주의 세균 현탁액을 배추 잎의 앞, 뒷면에 모두 병원균이 접종될 수 있도록 스프레이로 분무접종 하였다. Xcc 균주를 접종한 식물체는 30°C 습실상에서 암상태로 48시간 동안 습실처리한 후에, 항온항습실(25°C, 상대습도 80%)로 이동하여 하루에 12시간씩 광(photosynthetic photon flux density 55 µmol/m2·s1)을 조사하면서 재배하였다.
병조사
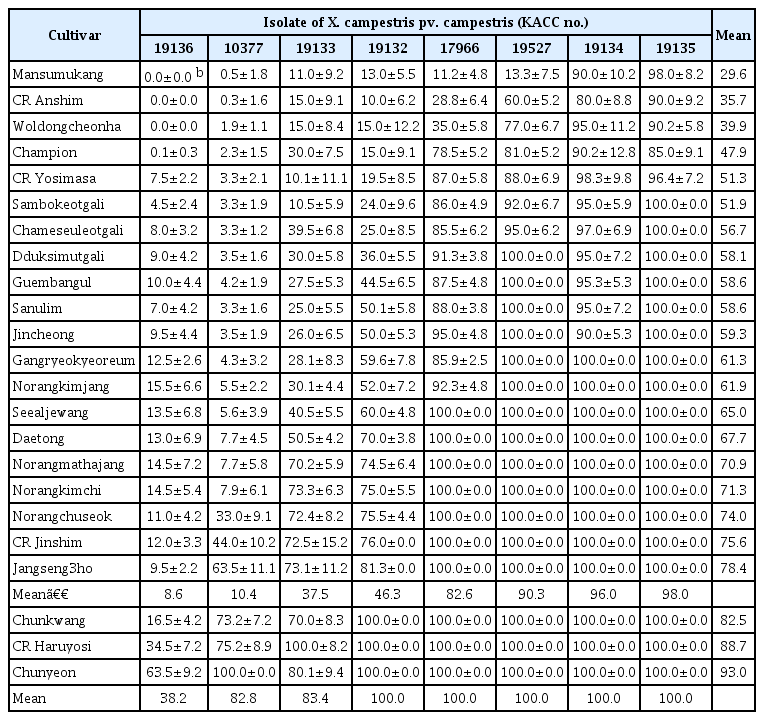
배추 품종들의 검은썩음병 발생 정도는 배추 잎에 발생한 검은썩음병 병반의 면적률 (%) 즉 전체 잎 면적 중 병반이 차지하는 면적의 비율(%)을 Xcc 균주를 접종하고 3일, 4일, 6일 및 8일 후에 달관조사하였다. 그리고 평균 병반면적률이 20% 이하이면 저항성으로, 21−40%는 중도저항성으로, 41% 이상은 감수성으로 판정하였다(Lee 등, 2020a). 그리고 Xcc 균주를 접종하고 3일, 4일, 6일, 8일 후에 조사한 각 품종의 병반면적률(%)를 사용하여 아래와 같은 식에 따라 병진전곡선면적(area under the disease progress curve, AUDPC)을 계산하였다(Jeger와 Viljanen-Rollinson, 2001; Madden 등, 2007).
n=병조사 수, ti= i 병조사 일의 접종 후 경과 일수, DSi = i 병조사 일의 병반면적률(%)
통계분석
모든 실험은 처리 당 10개 식물체를 접종하였으며, 실험은 2회 반복 수행하였다. 그리고 이들 결과는 SAS 프로그램(version 9.1, SAS Institute Inc., Cary, NC, USA)을 이용하여 ANOVA 분석을 하고, 처리 평균 간 비교를 위하여 Duncan's multiple range test (P=0.05)를 실시하였다.
결 과
배추검은썩음병균 8개 균주의 병원력
Xcc 8개 균주(KACC 10377, KACC 17966, KACC 19132, KACC 19133, KACC 19134, KACC 19135, KACC 19136, KACC 19527)의 병원력을 조사하기 위하여, Lee 등(2020a)의 보고를 바탕으로 Xcc에 대하여 감수성인 4개 배추 품종(‘ CR 농심’, ‘춘광’, ‘ CR 하루요시’, ‘춘연’)에 이들 균주를 접종하고 검은썩음병 발생을 조사한 결과, Xcc 8개 균주에 의한 배추 품종의 검은썩음병 발생은 배추 품종 간에는 큰 차이를 나타내지 않았으나, Xcc 균주에 따라 검은썩음병 발생에 뚜렷한 차이를 보였다(Fig. 1). 배추 검은썩음병 발생은 접종 4일 후부터 균주에 따라 큰 차이를 보여, KACC 19136 균주에 의해서 ‘ CR 농심’, ‘춘광’, ‘ CR 하루요시’, ‘춘연’에서 각각 5.3%, 3.0%, 8.0%, 12.5%의 병반면적률을 보일 뿐이었으나, KACC 19135 균주에 의해서는 CR 농심’, ‘춘광’, ‘ CR 하루요시’, ‘춘연’에서 각각 63.5%, 83%, 81%, 94.3%의 높은 병반면적률을 나타냈다(Fig. 1). 그리고 Xcc 8개 균주를 접종하고, 8일 후의 검은썩음병 발생을 비교하면, KACC 19136 균주를 접종한 경우는 4개 품종의 평균 병반면적률이 18.9%로 가장 낮았으며, 그 다음은 KACC 10377은 25.2%, KACC 19133은 36.9%, KACC 19132와 KACC 17966은 46.6%와 54.2%이었으며, KACC 19527과 KACC 19134의 경우 평균 병반면적은은 각각 88.8%와 92.1%이었다. 그리고 KACC 19135 균주에 의해서는 97.6%의 가장 높은 병반면적률을 보였다(Fig. 1).
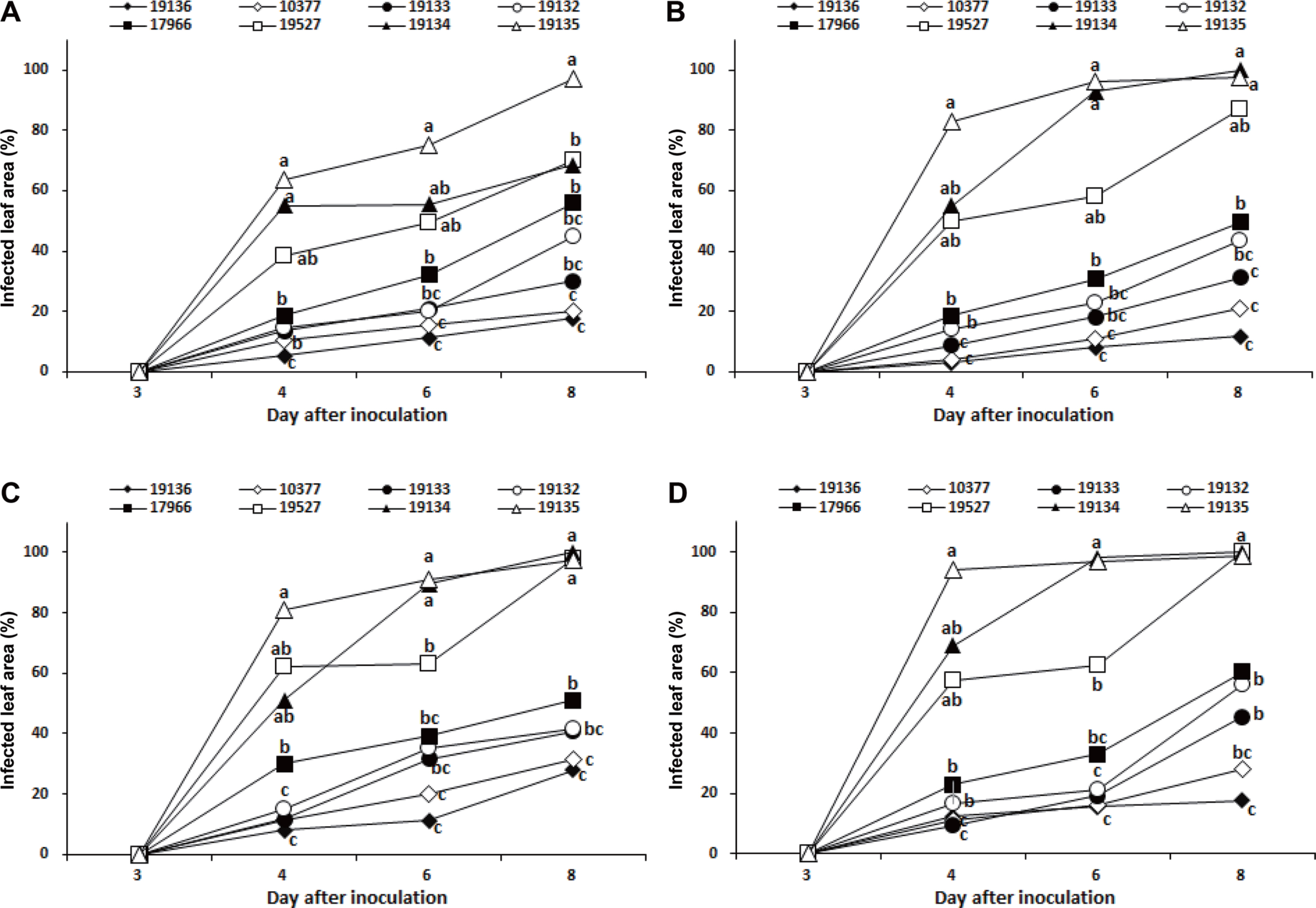
Development of black rot on four susceptible cultivars of Chinese cabbage caused by eight isolates of Xanthomonas campestris pv. campestris. (A) ‘CR Nongsim’. (B) ‘Chunkwang’. (C) ‘CR Haruyosi’. (D) ‘Chunyeon’. Ten-day-old seedlings were inoculated with a bacterial suspension of each isolate at a concentration of 1.0×108 cfu/ml by spray method. The inoculated plants were incubated in a humidity chamber at 30°C for 48 hr and then transferred to a growth chamber at 25°C and relative humidity 80% with 12 hr light a day. After three, four, six, and eight days, disease severity was measured as percentage of diseased leaf area of each plant. Each value represents the mean disease severity of two runs with 10 replicates each. Values labeled with the same letter within each day after inoculation are not significantly different based on Duncan's multiple range test at P=0.05.
Xcc 8개 균주를 접종하고 3일, 4일, 6일 및 8일 후에 검은썩음병 발생을 조사하고 이로부터 계산한 AUDPC값을 비교하면, ‘ CR 농심’은 162, ‘춘광’은 183, ‘ CR 하루요시’는 207, ‘춘연’은 209로 배추 품종 간에는 검은썩음병 발생에 큰 차이가 없었으나, Xcc 균주 간에는 검은썩음병 발생에 큰 차이를 나타냈다(Fig. 2). 배추 4개 품종에 발생한 검은썩음병의 AUDPC 평균값을 비교하면, KACC 19135 균주에 의해 가장 높은 395의 AUDPC를 보였으며, KACC 19134는 346, KACC 19527은 284, KACC 17966은 156, KACC 19132는 119, KACC 19133은 98.2, KACC 10377은 70.4이었다. 그리고 KACC 19136에 의해서는 가장 낮은 52.7의 AUDPC를 보일 뿐이었다(Fig. 2).
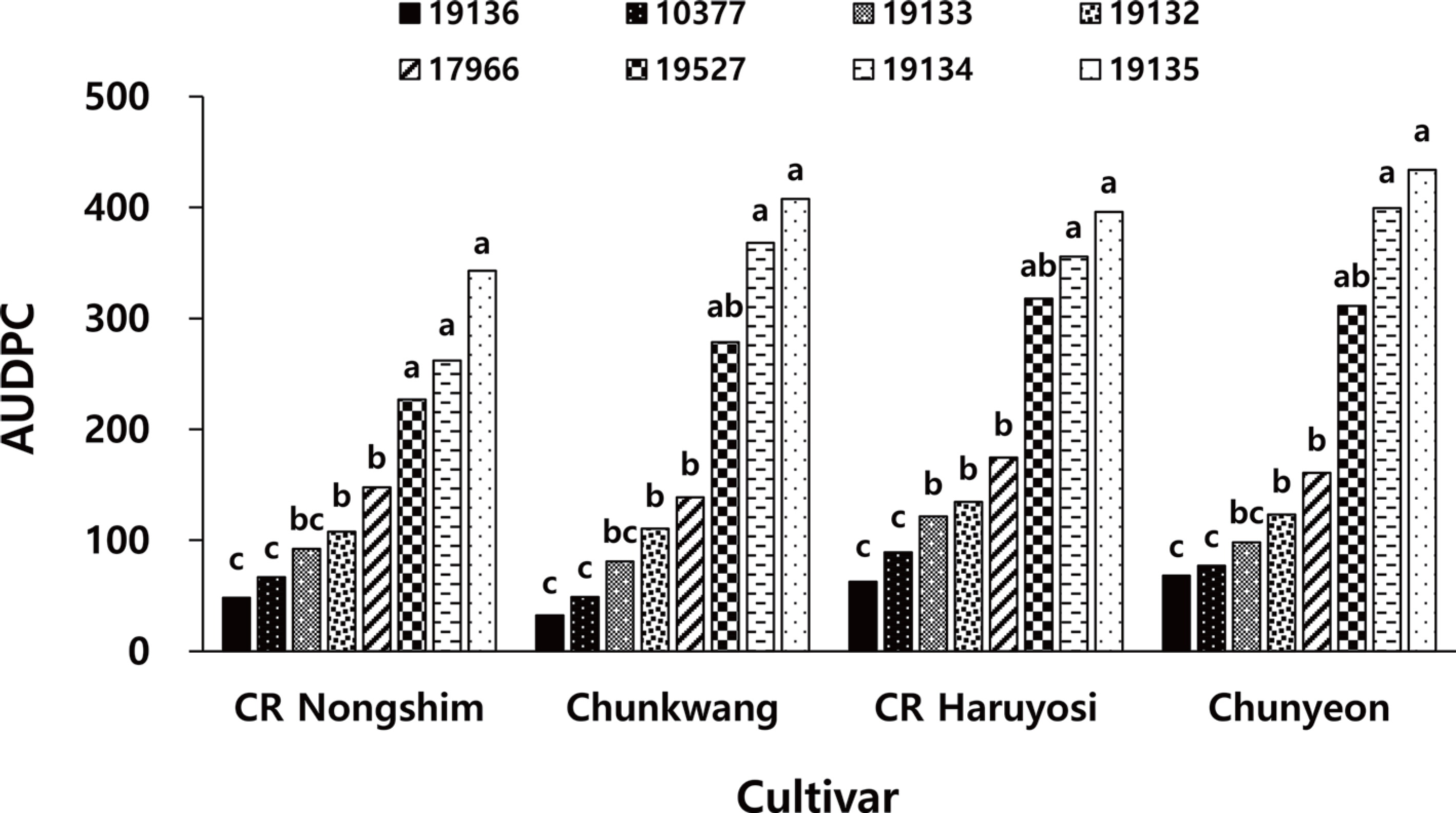
Area under the disease progress curve (AUDPC) of black rot on four Chinese cabbage cultivars caused by eight isolates of Xanthomonas campestris pv. campestris and AUDPC were calculated using the following equations. AUDPC=Σ n i=1 [t(i+1)– ti]×[DS(i+1)+ DSi]/2; n=number of assessments, ti=number of days elapsed from the inoculation day to the assessment date i, DSi=disease severity (%) on assessment date i. Each value represents the mean AUDPC of two runs with 10 replicates each. Values labeled with the same letter within each cultivar are not significantly different based on Duncan's multiple range test at P=0.05.
이들 결과로부터 실험에 사용한 Xcc 8개 균주들의 병원력은 KACC 19135가 가장 강하였고, 그 다음은 KACC 19134, KACC 19527, KACC 17966, KACC 19132, KACC 19133, KACC 10377 순이었으며, KACC 19136 균주는 병원력이 가장 낮음을 알 수 있었다. 그리고 각 Xcc 균주에 의한 4개 품종에서의 검은썩음병 발생의 AUDPC를 통계분석하면, 실험한 Xcc 8개 균주들은 크게 3개 그룹으로 나눌 수 있었다. 검은썩음병이 가장 많이 발생한 즉, 병원력이 가장 강한 그룹은 KACC 19135, KACC 19134 및 KACC 19527 균주, 병원력이 중간인 그룹은 KACC 17966, KACC 19132, KACC 19133 그리고 병원력이 낮은 그룹은 KACC 10377과 KACC 19136 균주이었다(Figs. 1, 2).
Xcc 8개 균주에 의한 배추 23개 품종의 검은썩음병 발생
배추의 검은썩음병 저항성에 대하여 Xcc 균주들의 레이스 분화 여부를 조사하기 위하여, Lee 등(2020a)의 결과를 바탕으로 Xcc KACC 10377에 대하여 저항성 혹은 중도저항성을 나타낸 20개 품종(‘만수무강’, CR 안심’, ‘월동천하’, ‘챔피온’, ‘ CR 요시사마’, ‘삼복엇갈이’, ‘참이슬엇갈이’, ‘뚝심엇갈이’, ‘금방울’, ‘산울림’, ‘진청’, ‘강력여름’, ‘노랑김장’, ‘씨알제왕’, ‘대통’, ‘노랑맛하장’, ‘노랑김치’, ‘노랑추석’, ‘ CR 진심’, ‘장생3호’)과 감수성 3개 품종(‘춘광’, ‘ CR 하루요시’, ‘춘연’)에서 Xcc 8개 균주에 의한 검은썩음병 발생을 실험한 결과, 실험한 대부분의 배추 품종은 접종한 Xcc 균주의 병원력이 증가할수록 검은썩음병 발생이 증가하였다(Table 1).
그리고 Xcc 8개 각 균주에 의한 저항성 및 중도저항성 배추 품종에서의 검은썩음병 발생을 평균한 병반면적률(%)은 KACC 19136, KACC 10377, KACC 19133, KACC 19132, KACC 17966, KACC 19527, KACC 19134, KACC 19135 균주에 의해 각각 8.6, 10.4, 37.5, 46.3, 82.6, 90.3, 96.0, 98.0%의 병반면적률(%)을 보였다(Table 1). 즉, KACC 19135 균주에 의한 검은썩음병 발생이 가장 많았고, 그 다음은 KACC 19134, KACC 19527, KACC 17966, KACC 19132, KACC 19133, KACC 10377 순이었으며, KACC 19136 균주에 의한 검은썩음병 발생은 가장 적었다.
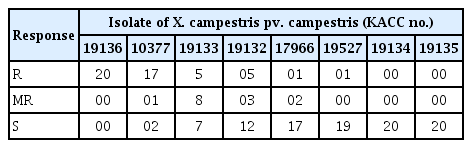
그리고 실험한 저항성 및 중도저항성 20개 배추 품종 중 Xcc 8개 균주 모두에 저항성을 보인 품종은 없었다(Table 2). 실험한 품종 중 가장 많은 균주에 저항성을 보인 ‘만수무강’은 병원력이 가장 강한 KACC 19135와 KACC 19134 균주에 대해서는 감수성 반응을 나타냈으나, 나머지 Xcc 6개 균주에 대하여는 저항성 반응을 보였다(Table 2, Fig. 2). 그 다음은 ‘ CR 안심’과 ‘월동천하’로 병원력이 상대적으로 약한 4개 균주(KACC 19136, KACC 10377, KACC 19133, KACC 1932, KACC 17966)에 대해서는 저항성 및 중도저항성 반응을 보였지만, 병원력이 강한 KACC 19135, KACC 19134, KACC 19527에 대해서는 감수성 반응을 나타냈다(Table 2, Fig. 2). 실험한 품종 대부분은 Xcc에 대한 저항성이 가장 약한 ‘ CR 진심’과 ‘장생3호’는 병원력이 가장 약한 KACC 19136에 대해서만 저항성을 나타냈고, 나머지 Xcc 7개 균주에 대해서는 저항성 반응을 나타내지 않았다(Table 2, Fig. 2).
실험한 저항성 및 중도저항성 배추 품종 20개 중 Xcc 균주 각각에 대한 저항성 품종의 수를 비교하면, 병원력이 가장 강한 KACC 19135와 KACC 19134 균주에 대해서는 저항성을 나타내는 품종이 없었으며, KACC 19527과 KACC 17966 균주는 1개, KACC 19132와 KACC 1933 균주에 대해서는 5개 그리고 병원력이 약한 KACC 10377과 KACC 19136에 대해서는 각각 17개와 20개 품종이 저항성을 보였다(Table 3, Fig. 2). 이와 반대로 감수성을 나타내는 품종은 병원력이 강한 KACC 19135와 KACC 19134 균주에 대해서는 20개였으나, 병원력이 가장 약한 KACC 19136과 KACC 10377에 대해서는 각각 0개와 2개 품종이 감수성 반응을 보일 뿐이었다(Table 3, Fig. 2).
고 찰
배추에 검은썩음병을 발생시키는 Xcc의 병원력을 조사하기 위하여, Xcc에 대하여 감수성인 배추 4개 품종에 Xcc 8개 균주를 접종하고 이들 품종에서의 검은썩음병 발생을 통해 Xcc 균주들의 병원력을 비교하였는데, 실험한 Xcc 8개 균주 중 KACC 19135가 가장 강한 병원력이 강한 균주였으며, 그 다음은 KACC 19134, KACC 19527, KACC 17966, KACC 19132, KACC 19133 순이었으며, KACC 19136은 병원력이 가장 약한 균주이었다(Figs. 1, 2). 따라서 실험한 Xcc 균주들은 배추에서 뚜렷한 병원력 차이를 보였다.
많은 식물병원균들은 각 식물병원균의 균주들 간에 병원력 (virulence)에 차이가 있다고 보고되었다. Jo 등(2016)은 뿌리혹병균의 경우에 P. brassicae 4개 균주가 양배추에 대해 병원력에 차이가 있음을 보고하였다. 그리고 Lee 등(2018)도 R. solanacearum 14개 균주가 고추 품종에 대해 병원력에 따라 6개 그룹으로 구분할 수 있다고 하였다. 또한 고추역병균(Phytophthora capsici) 경우에도 많은 연구자들이 P. capsici 균주들 간에 병원력에 차이가 있음을 보고하였다(Foster와 Hausebeck, 2010; Jo 등, 2014; Yang 등, 1989). 뿐만 아니라 무시들음병균(Fusarium oxysporum f. sp. raphani) 8개 균주도 병원력에 따라 크게 3개 그룹으로 구분할 수 있다고 하였다(Lee 등, 2020b).
한편, Lee 등(2020a)이 보고한 Xcc KACC 10377에 의한 88개 배추 품종들의 검은썩음병 발생 결과로부터 저항성 및 중도저항성을 보이는 배추 20개 품종을 선발하여, Xcc 8개 균주를 각각 접종하고 이들 품종에서의 검은썩음병 발생 및 저항성 정도를 조사한 결과, 실험한 대부분의 품종들은 Xcc 균주들의 병원력에 비례하여 검은썩음병이 발생하였다(Table 1, Fig. 2). 그리고 Xcc 각 균주에 의한 20개 배추 품종의 검은썩음병 발생을 평균한 병반면적률(%)을 비교하였을 때에도 Xcc 균주의 병원력이 높을수록 검은썩음병 발생이 증가하였고, 각 Xcc 균주에 대한 저항성 품종의 수는 실험에 사용한 Xcc 균주들의 병원력과 반비례하여 증가하였고, 감수성 품종의 수는 Xcc 균주들의 병원력에 비례하여 감소하였다(Table 3, Fig. 2). 즉, 대부분의 품종들은 실험한 Xcc 균주들의 병원력에 반비례하여 저항성을 나타냈다.
이들 결과로부터 Xcc 8개 균주에 대한 배추 품종들의 저항성에서는, 질적 저항성에서 발견되는 저항성 식물과 병원균 균주들 간의 특이적 관계는 발견할 수 없었다(Hibberd 등, 1987; Kim 등, 2016; Kuginuki 등, 1999; Ramirez-Villupadua 등, 1985; Risser 등, 1976). 따라서 배추의 Xcc 균주에 대한 저항성은 질적 저항성이 아닌 양적 저항성이며, 저항성 배추 품종은 접종한 Xcc 균주의 병원력에 반비례하여 저항성을 나타냄을 알 수 있었다.
병원균에 대한 저항성 품종을 개발하기 위한 병 저항성 검정(병리검정) 방법은 작물의 병원균에 대한 저항성이 양적 저항성인지 질적 저항성인지에 따라 달라지게 된다. 작물의 저항성이 질적 저항성인 경우에는 레이스 분화가 일어나게 되는데 대표적인 예로 멜론의 덩굴쪼김병 저항성이다. 멜론의 Fom-1과 Fom-2 유전자에 의해 저항성이 나타나게 되는데, 병원균인 F. oxysporum f. sp. melonis는 이들 유전자를 침입할 수 있는지를 기준으로 레이스 0, 레이스 1, 레이스 2, 레이스 1, 2로 구분한다(Risser 등, 1976). 따라서 저항성 품종을 개발하기 위해서는 교배에 이용하는 유전자원의 저항성에 적합한 병원균의 레이스를 사용하여 실험하는 것이 필요하다. 예를 들면, Fom-2 저항성 유전자가 들어있는 멜론 품종을 개발하기 위해서는 레이스 1인 F. oxysporum f. sp. melonis 균주를 사용하여 저항성을 검정하고, Fom-1와 Fom-2 저항성 유전자가 모두 도입된 멜론 품종을 개발하기 위해서는 레이스 1과 레이스 2를 혼합하여 접종하고 저항성 검정을 수행하면 된다.
이와 달리 양적 저항성의 경우에는 저항성 유전자에 대한 병원균의 레이스 분화는 없고, 병원균의 병원력에 반비례하여 저항성을 나타낸다. 그 대표적인 예로 고추의 역병 저항성과 고추의 풋마름병 저항성이다. P. capsici에 대한 고추의 역병 저항성은 P. capsici 균주의 병원력에 반비례하여 고추 품종들의 저항성에 차이를 보인다고 하였다(Foster와 Hausbeck, 2010; Jo 등, 2014, 2016; Yang 등, 1989). 그리고 Lee 등(2018) 고추의 풋마름병 저항성은 고추풋마름병균의 병원력에 반비례하다고 하였다. 따라서 양적 저항성인 경우에는 실험하고자 하는 목적에 적합한 병원력을 가지는 균주를 선발하여 실험하는 것이 요구된다.
본 연구의 결과를 바탕으로 배추 검은썩음병 저항성 품종 개발을 위한 병리검정 전략을 다음과 같이 제안하고자 한다. 검은썩음병에 대한 저항성 계통(모본 혹은 부본)을 만들기 위한 교배 집단의 병 저항성 개체 선발은, 세대가 진전됨에 따라 저항성이 약해지는 경향을 나타내는 것을 고려하여 초기 세대 선발에서는 KACC 19135와 KACC 19134 균주와 같이 강한 병원력을 가지는 균주를 사용하여 실험하고, 후기 세대 선발이나 F1 품종의 저항성 정도를 확인하기 위해서는 중간 정도의 병원력을 보이는 KACC 19132 혹은 KACC 19133 균주를 사용하여 저항성을 검정하는 것이 효과적일 것으로 생각되었다.
Notes
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.
Acknowledgments
This work was supported by IPET (322059-3), funded by Ministry of Agriculture, Food and Rural Affairs (MAFRA).