국내 주요 참다래 재배지에 발생하는 뿌리혹선충 종류 및 분포
Occurrence and Distribution of Root-Knot Nematodes in Kiwifruit Orchard
Article information
Abstract
국내 참다래 주산지인 전라남도, 경상남도, 제주도 지역의 참다래 재배지 총 102개 지점을 대상으로 식물기생선충 종류와 밀도를 조사하였다. 검출된 식물기생선충은 뿌리혹선충(Meloidogyne spp.), 나선선충(Helicotylenchus spp.), 침선충(Paratylenchus spp.) 등 9개의 속이었으며, 102개 재배지 중 56%의 재배지가 뿌리혹선충에 감염되어 있는 것으로 나타나 국내 참다래 재배지에서 가장 중요한 식물기생선충은 뿌리혹선충이었다. 뿌리혹선충의 평균 밀도는 97마리/300 cm3 토양으로 참다래의 수량 감소 피해가 우려된다. 뿌리혹선충의 종을 동정한 결과, M. arenaria, M. hapla, M. incognita, M. javanica 4종이 확인되었으며, 그 중 M. arenaria가 가장 우점하고 있다. 그 중 M. arenaria가 가장 우점하고 있다. 과수류에서의 식물기생선충 감염 경로는 감염된 묘목의 이식을 통한 확산이 많음으로 참다래 묘목 생산 및 보급단계에서 뿌리혹선충 무균묘 생산에 주의를 기울여야 할 것이다.
Trans Abstract
The study was conducted to investigate the infestation and distribution of plant-parasitic nematodes on kiwi orchards in Korea. Plant parasitic nematodes genus and densities were investigated at a total of 102 sites in Jeollanam-do, Gyeongsangnam-do, and Jeju-do, which are the main production areas of domestic kiwi orchards. Plant parasitic nematodes detected were of 9 genera, including root-knot nematodes (Meloidogyne spp.), spiral nematodes (Helicotylenchus spp.), and needle nematodes (Paratylenchus spp.), and 56% of the 102 plantations were infected with root-knot nematodes. Root-knot nematodes were found to be the most important plant parasitic nematode in domestic kiwi orchards. The average density of root-knot nematodes is 97 per 300 cm3 soil, and there is concern about the kiwi yield reduction. As a result of identifying the root-knot nematode species: M. arenaria, M. hapla, M. incognita, and M. javanica. Among them, M. arenaria is the most dominant. As the plant parasitic nematode infection route in fruit trees is often spread through the transplantation of infected seedlings, attention should be paid to the production of nematode-free plants during the production and supply of kiwifruit plants.
서 론
참다래(kiwifruit, Chinese gooseberry)는 다년생 덩굴성 낙엽과수로 다래나무속(Actinidia)에 속하며 1920년경 뉴질랜드에서 다래종자를 중국으로부터 도입하고 우량계통을 선발하여 보급하면서 산업화되었다(Kang 등, 2021). 우리나라에서는 월동이 가능한 제주도를 비롯한 남부 해안지역에서 1980년대 묘목을 들여와 재배하기 시작하였다(Kwon 등, 2011). 국내에서 재배되는 참다래 품종은 과육색이 녹색인 그린참다래(A. deliciosa)와 황색인 골드참다래(A. chinensis)로 국내 재배 면적이 2007년 992 ha에서 2013년 1,331 ha로 증가되면서 고급 과실로서 농가소득에 이바지하고 있다(Kim과 Koh, 2018; Moon 등, 2014).
참다래의 국내 생산량은 2017년 약 25,000톤에 달했으며, 주요 재배지역은 전라남도(45%), 경상남도(31%), 제주도(24%) 순으로 나타났다(Kim 등, 2018). 온대 해양성 기후에서 재배되고 생산되는 참다래는 기후변화로 인해 우리나라에서 재배 면적이 늘어날 것으로 예상되나 생산량을 감소시킬 수 있는 요인인 주요 병해충은 궤양병, 뽕나무깍지벌레, 꽃썩음병, 열매꼭지나방 등이 있으며, 뿌리를 가해하고 기생하는 식물기생선충(plant-parasitic nematodes)도 피해를 주는 해충 중 하나이다.
식물기생선충은 벼, 바나나, 포도, 토마토, 감자, 옥수수, 콩 등 다양한 농작물의 뿌리, 잎, 줄기 등을 가해하여 농업에 막대한 피해를 주고 있다(Fourie 등, 2017; Li 등, 2015). 참다래 근권에서 발생 보고된 식물기생선충으로는 뿌리혹선충류(Meloidogyne spp.), 나선선충류(Helicotylenchus spp., Rotylenchus spp.), 씨스트선충류(Heterodera spp.), 뿌리썩이선충류(Pratylenchus spp.), 침선충류(Paratylenchus spp.), 궁침선충류(Paratrichodorus spp.), 위축선충류(Tylenchorhynchus spp.) 등이 알려져 있으며, 그 중에서 뿌리혹선충류로 인한 피해가 가장 심하다(Castillo 등, 1993; Sekhukhune 등, 2022; Watson 등, 1992).
뿌리혹선충은 현재까지 100종 이상이 보고되어 있으며, 참다래에 뿌리에 기생한다고 알려져 있는 뿌리혹선충은 Meloidogyne aberrans, M. actinidiae, M. arenaria, M. cruciani, M. ethiopica, M. hapla, M. incognita, M. javanica, M. luci 등 9종이다(Carneiro 등, 2003; Choo, 1985; Conceição 등, 2012; Di Vito 등, 1988; Li와 Yu, 1991; Tao 등, 2017; Verdejo-Lucas, 1992; Vovlas와 Roca, 1976). 국내에 분포하는 뿌리혹선충은 9종(M. arenaria, M. chitwoodi, M. cruciani, M. hapla, M. hispanica, M. incognita, M. javanica, M. mali, M. marylandi)이 보고되어 있으며, 참다래에 기생하는 뿌리혹선충은 M. cruciani와 M. hapla 2종이 알려져 있다(Choo, 1985; Ma 등, 2007).
최근 참다래의 재배연수가 늘어나면서 뿌리혹선충에 의한 피해가 우려되나 국내에서 발생 실태가 조사된 바 없다. 본 연구에서는 국내 참다래 주산지를 대상으로 뿌리혹선충의 발생 실태를 파악하고 형태 및 분자생물학적 종 동정을 통해 우점하고 있는 종을 분석하여 식물기생선충의 종합적 방제를 위한 기초자료로 활용하고자 수행하였다.
재료 및 방법
시료 채집.
국내 주요 참다래 재배지인 전남, 경남, 제주 지역을 대상으로 2021년 8월에서 10월간 재배 농가 필지별로 참다래 식물체 주변의 근권 토양 및 뿌리를 직경 2 cm 토양 시료 채취기를 이용하여 깊이 15 cm 정도 채취하였으며, 1개의 재배필지 당 최소 10 지점을 기준으로 토양 약 2 kg 채집하고 실험실로 운반하여 선충 분리에 사용하였다. 선충의 분리는 120, 400 mesh 채를 이용하였는데 400 mesh에 걸린 흙을 kitchen towel (Monalisa Co., Seoul, Korea)를 여과지로 하여 깔때기가 아닌 체를 이용한 개량된 Baermann funnel법으로 12시간 분리하였다(Kang 등, 2016; Southey, 1986). 분리된 선충은 counting dish에 넣고 40배 해부현미경하에서 식물기생선충의 속별로 밀도를 조사하였다.
뿌리혹선충 증식.
채집된 뿌리 시료에서 발견되는 뿌리혹선충의 암컷이 충분하지 않으면 토마토 식물에 접종하여 선충을 증식한 다음 실험에 사용하였다. 뿌리혹선충의 감수성인 토마토(cv. Rutger) 원예용 상토(Punong Co., Gyeongju, Korea)를 넣은 육묘 상자(20구 트레이)에 종자를 파종한 후 21일간 키운 다음 멸균된 모래와 클레이를 8:2로 혼합한 토양을 채운 직경 10 cm 토분에 1포기씩 이식하면서 채집된 토양으로부터 분리한 뿌리혹선충을 glass tip pipette을 이용하여 접종한 후 온실(25° C)에서 60일 이상 증식하였다(Jang 등, 2021).
형태학적 종 동정.
분리된 선충을 70 o C의 formaldehyde 와 glycerine을 4:1 비율로 혼합된 고정액으로 고정한 다음 Seinhorst’ s rapid glycerin법으로 Cobb 슬라이드 영구 표본을 제작하였다(Southey, 1986). 선충의 형태적 특징 분석은 광학현미경(BX53, Olympus, Tokyo, Japan)으로 형태적 특징을 관찰하고 부착된 디지털카메라(DP73, Olympus)로 형태를 촬영하였다. 뿌리혹선충의 암컷을 이용한 형태적 종 동정은 참다래 나무의 뿌리를 찢어 뿌리혹선충 암컷을 10마리씩 잡아내어 45% lactic acid가 들어있는 Petri dish에 옮겼다. Petri dish 위에서 선충 암컷의 중간 부분을 해부칼로 끊어 털바늘로 가볍게 비벼 내용물을 제거하였으며, 꼬리 부분의 perineal pattern과 머리 부분의 excretory pore 표본을 따로 제작하였다. 한 슬라이드 위에 머리와 꼬리를 상하로 같이 두어 제작하여, 형태적 특징을 관찰하고 촬영하였다(Taylor와 Netscher, 1974).
뿌리혹선충 분자생물학적 종 동정.
뿌리혹선충 암컷 10마리 정도를 뿌리로부터 분리하여 DNeasy Blood & Tissue Kit (Qiagen, Hilden, Germany)으로 DNA를 추출하였으며, 추출된 DNA는 뿌리혹선충의 종 동정을 위하여 사용되는 mitochondrial DNA (mtDNA)의 COII/lrRNA 영역을 polymerase chain reaction (PCR) 증폭하기 위하여 forward primer인 C2F3 (5′-GGTCAATGTTCAGAAATTTG-3′)와 reverse primer인 1108 (5′-TACCTTTGACCAATCACGCT-3′)를 이용하였으며, tRNA(His)/ lrRNA 영역의 증폭을 위하여 forward primer인 TRNAH (5′-TGAATTTTTTATTGTGATTAA-3′)와 reverse primer인 MRH106 (5′-AATTTCTAAAGACTTTTCTTAGT-3′)를 이용하여 분석하였다(Powers와 Harris, 1993; Stanton 등, 1997). 각 PCR products 는 Accuprep Gel Purification Kit (Bioneer, Daejeon, Korea)를 이용하여 정제한 다음 제한효소 HinfI을 처리한 후 agarose gel 에 전기영동 시켜 나타나는 DNA 절편의 패턴을 관찰하여 종을 동정을 하였다(Oh 등, 2009).
결과 및 고찰
국내 참다래 주산지인 경남, 전남, 제주 지역 재배지 102포장을 대상으로 식물기생선충을 조사한 결과, 뿌리혹선충(Meloidogyne spp.), 나선선충(Helicotylenchus spp., Rotylenchus spp., Scutellonema spp.), 뿌리썩이선충(Pratylenchus spp.), 침선충(Paratylenchus spp.), 위축선충(Tylenchorhynchus spp.), 껍질선충(Hemicycliophora spp.), 감귤선충(Tylenchulus spp.) 등 9속의 식물기생선충이 발견되었다(Table 1).
뿌리혹선충은 참다래 재배지에서 감염률이 56%로 가장 높았으며, 평균 밀도도 97마리/300 cm3 토양으로 높았다. 다음으로 참다래 재배지의 분포하는 식물기생선충은 나선선충으로 감염율이 16%로 나타났으며, 그 외 식물기생선충은 10% 이하로 국내 참다래 재배지의 가장 큰 피해를 주는 선충은 뿌리혹선충이었다(Table 1). 뿌리혹선충은 작물 뿌리로 침투하여 혹을 형성시키고 식물체의 양분을 섭취하여 성장장애, 시들음, 잎의 황화를 일으킨다(Jones 등, 2013). 특히 뿌리혹선충은 경제적 피해한계 밀도가 작물별로 다양하나 토양 100 cm3당 1마리(알)로 낮은 경우도 있어 방제가 중요하며, 종별로 기주 특이성이 있어 뿌리혹선충 친환경 방제방법인 윤작, 저항성 품종 재배 등의 적용연구를 위하여 그 종의 동정이 매우 중요하다(Kang 등, 2018).
경상남도, 전라남도, 제주도 참다래 재배지에서 검출된 40점의 뿌리혹선충 암컷 머리부분의 excretory pore 위치(Fig. 1)와 꼬리부분의 perineal pattern (Fig. 2)의 형태적 특성 및 분자생물학적 동정 결과, M. arenaria (16점, 40%), M. hapla (10점, 25%), M. incognita (3점, 8%), M. javanica (5점, 13%), 미확인종(6점, 15%) 등이었다(Table 2). 머리부분의 excretory pore 의 위치가 구침의 바로 옆에 있으면 M. incognita 또는 M. hapla 로, 구침(stylet) 길이의 2배 뒤쪽에 있으면 M. arenaria로 동정된다. 꼬리부분의 perineal pattern에 점(punctation)이 있으면 M. hapla로 동정된다(Kim 등, 2001). M. javanica는 perineal pattern의 굵은 옆줄을 가지고 있어 2줄이 있는 것처럼 보인다(Rammah와 Hirschmann, 1990). 지역별로 뿌리혹선충 감염 종에 차이가 있었는데, 경남에서는 10개 포장 중 M. arenaria 와 M. hapla가 가장 많았고(8 포장), 전남에서는 M. arenaria, M. javanica가 비슷하게 감염되어 있었으며, 제주도에서는 22개 포장중에서 M. arenaria와 M. hapla가 가장 많았다(15 포장). 경남에서는 M. javanica가 발견되지 않았고, M. incognita는 제주에서만 발견되었다(Table 2).
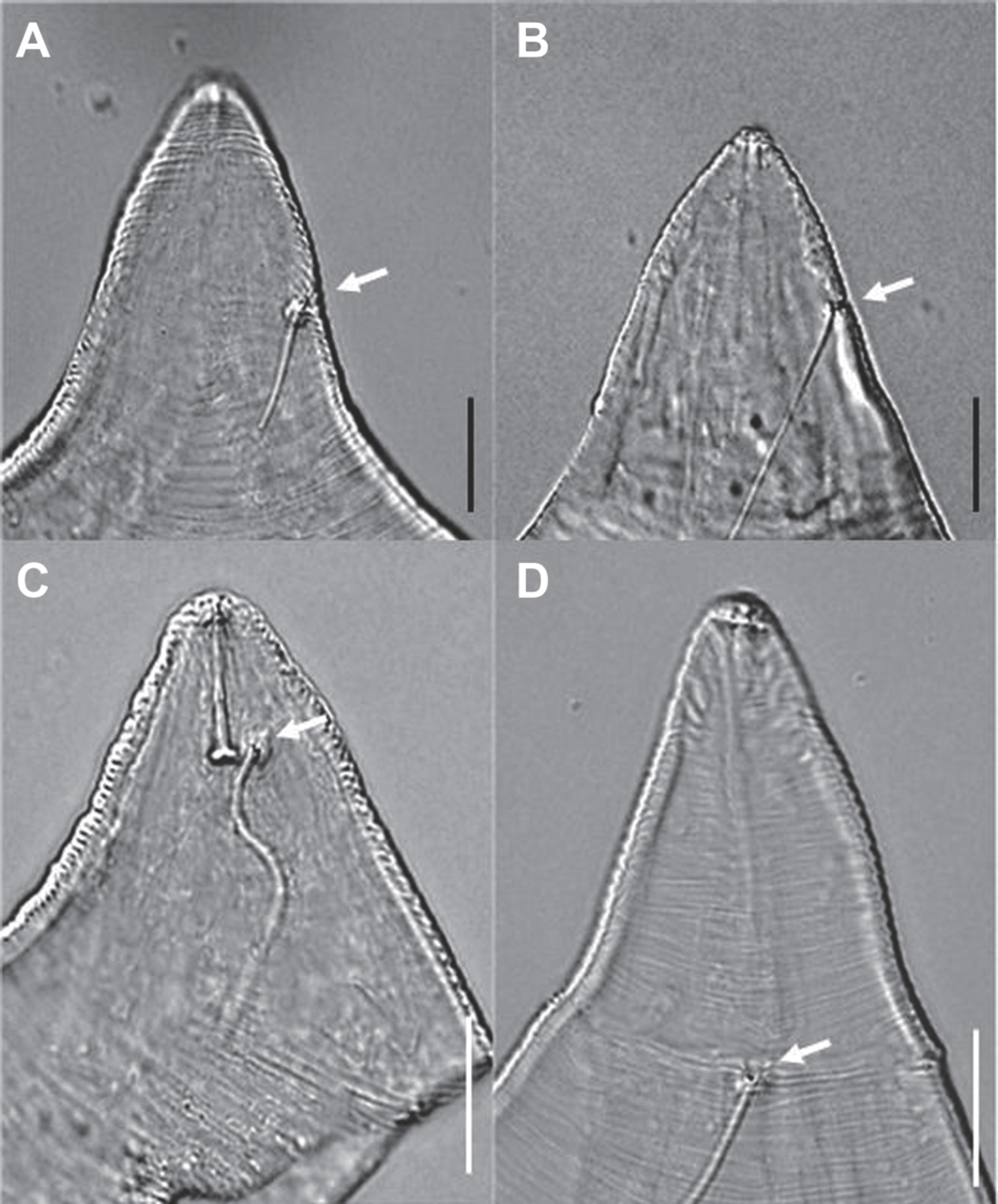
Position of excretory pore of female Meloidogyne species. (A) Meloidogyne arenaria. (B) M. hapla. (C) M. incognita. (D) M. javanica. The arrows indicate excretory pore. Scale bars = 20 μm.

Perineal patterns of Meloidogyne species. (A) Meloidogyne arenaria. (B) M. hapla. (C) M. incognita. (D) M. javanica. Scale bars = 20 μm.
Esbenshade와 Triantaphyllou (1985)는 전 세계 65개국 291점의 뿌리혹선충을 조사한 결과, 전 세계적으로 M. incognita 가 가장 많이 분포하고(36.4%), 다음으로 M. arenaria (19.2%), M. javanica (15.8%), M. hapla (11.7%), 기타(16.9%)라고 하였다. 6년생 참다래나무에서 식물기생선충을 조사한 결과 Helicotylenchus, Heterodera, Pratylenchus, Paratylenchus, Tylenchus, Paratrichodorus 등이 일부 발견되었으나 참다래에 피해를 주는 가장 중요한 선충은 뿌리혹선충 M. hapla라고 보고하였으며(Watson 등, 1992), M. hapla에 감염된 참다래 나무는 토양 300 cm3당 3,000마리(알과 유충)일 경우 뿌리에 현저한 피해를 보였다고 보고하였다(Ma 등, 2007). 중국의 참다래 재배지에서 가장 중요한 식물기생선충은 M. incognita였으며(Chen 등, 2018), M. incognita에 대한 경제적 피해한계밀도는 토양 300 cm3당 129마리(알과 유충) 수준일 때이고, 초기밀도가 토양 300 cm3당 9,600마리(알과 유충)일 경우에는 참다래의 생육이 55% 감소되었다고 보고하였다(Di Vito 등, 1988). 본 연구에서는 국내 참다래 재배지(경남, 전남 및 제주) 시료의 56%에서 토양 300 cm3당 평균 97.3마리의 뿌리혹선충이 검출되었고, 지역에 따라서 평균 선충 밀도가 Di Vito 등(1988)이 제시한 경제적 피해한계밀도에 근접하거나 이를 상회했다(Table 1). 특히, 경남 창원시, 고성군 및 제주 제주시 서귀포시 일대의 농원 중 30–73%에서 토양 300 cm3당 평균 142.9–186.7 마리의 뿌리혹선충이 검출되어, 참다래 농가에 피해가 우려된다(Table 1). 형태학적 분자생물학적 분류 방법을 통해서 시료 내 뿌리혹선충 종을 분석한 결과 주로 검출된 종은 기존 연구와 차이가 있었다(Table 2). 전체 40개의 시료 중 16개 시료에서 M. arenaria가 10개 시료에서 M. hapla가 검출되었고, 제주의 3개 시료에서만 M. incognita 가 검출되어, 국내 참다래 재배지에서 우점하는 종은 M. arenaria와 M. hapla로 나타났다(Table 2).
참다래 주 재배지는 경상남도, 전라남도 및 제주도이며 제주에서는 참다래의 계약재배가 활발히 이루어지고 있다. 제주 참다래 재배지의 뿌리혹선충 20개 재배지의 암컷을 분리하여 DNA를 추출하고 미토콘드리아 DNA의 COII/lrRNA 영역을 증폭시킨 결과 DNA 단편의 크기가 약 550 bp에 해당하는 M. hapla가 7개 재배지에서 확인되었고, 1.1 kbp에 해당하는 M. arenaria가 12개 재배지에서 확인되었다. M. incognita, M. javanica와 M. hispanica에 해당하는 1.7 kbp의 PCR 산물은 7개의 시료(Jj-k7, Jj-k9, Jj-k10, Jj-k11, Jj-k12, Jj-k14, Jj-k17)에서 검출되었다(Fig. 3). Agarose gel 상에(Fig. 3) 나타나는 PCR 산물을 정제하여 Hinf I 제한효소를 처리하였을 때, Jj-k7, Jj-k9, Jj-k10, Jj-k14 시료에서 나타나는 1.7 kbp의 PCR 산물이 약 1.3 kbp 단편과 400 bp의 단편으로 절단되는 것을 확인하고(Fig. 4), 이를 M. incognita로 동정하였다(Powers와 Harris, 1993). 한편, Jj-k11, Jj-k12, Jj-k17 시료는 Hinf I 제한효소로 절단된 단편의 크기가 특이하여, 뿌리혹선충의 종을 특정할 수 없었다(Fig. 4).

Amplified polymerase chain reaction products of COⅡ/lrRNA region of the mitochondrial DNA from root-knot nematodes isolates of kiwi orchards in Jeju.
Choo (1985)는 남해 참다래 재배지에서 M. cruciani를 보고하였다. 그러나 이번 경남, 전남, 제주의 참다래 재배지 80포장의 40점의 뿌리혹선충을 대상으로 형태적 및 분자생물학적 종 동정을 실시한 결과, M. cruciani는 발견되지않았다. M. cruciani 는 perineal pattern이 M. hapla와 매우 비슷한데, 차이점은 M. cruciani는 항문(anus) 부위에 점이있고 M. hapla는 꼬리 부근에 점이 있다는 점이다. 또한, 유충의 전체 길이가 M. hapla는 평균 337 μ m (312–355 μ m)인 반면 M. cruciani는 평균 435 μ m (418–480 μ m)로 더 길다(Garcia-Martinez 등, 1982). M. cruciani 와 유사한 perineal pattern을 가진 M. hapla로 동정된 종들을 대상으로 perineal pattern을 재확인하였지만 모두 항문보다는 phasmids 사이에 점이 위치하고, 분자생물학적 분석법에 의해서도 모두 M. hapla로 동정되었다. 따라서 현재 M. cruciani는 조사한 지역에는 거의 존재하지 않을 것으로 판단된다.
본 연구결과 국내 참다래 재배지에서 가장 중요한 식물기생선충은 뿌리혹선충이었으며, 그 종은 주요 뿌리혹선충인 M. arenaria, M. hapla, M. incognita, M. javanica 등 4종이 지역에 따라 다르게 분포하고 있는 것으로 나타났다. 과수류는 일단 포장에 정식되면 뿌리혹선충을 포함한 식물기생선충의 방제가 매우 어렵다. 과수류에서의 식물기생선충 감염 경로는 묘목을 통한 감염이 많음으로 참다래 묘목생산 및 보급에서 뿌리혹선충 무균묘 생산에 주의를 기울여야 할 것이다.
Notes
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.
Acknowledgments
This work was supported by a 2-Year Research Grant of Pusan National University.



