미생물을 활용한 친환경적인 벼 병해 방제법
Biocontrol of Rice Diseases by Microorganisms
Article information
Abstract
벼는 전 세계 30억 인구의 식량 공급원으로 아시아 인구의 약 절반이 쌀을 식량자원으로 의존하며 100개 이상의 국가에서 재배되고 있다. 따라서 벼의 병해충에 따른 경제적 손실과 수확량 감소는 식량 수요와 공급을 위협할 수 있다. 벼에 발생하는 병해충을 방제하기 위해 가장 일반적으로 사용되는 방법은 농약을 통한 화학적 방제이다. 그러나 이러한 농약을 통한 환경 오염, 잔류 독성, 내성 병원균 출현, 토양 품질 저하 및 생물 다양성 파괴 등의 문제를 야기할 수 있다. 벼의 병해를 방제하기 위한 최근의 대안으로 미생물을 포함한 환경친화적인 생물학적 방제에 대한 연구가 활발히 진행되고 있다. 미생물 작용제는 식물 병원균과의 경쟁, 항생제 효과 및 기생을 통해 식물 병을 방제 할 수 있다. 벼 근권에서 분리한 미생물들, 예를들어 Bacillus spp., Pseudomonas spp., Trichoderma sp. 등은 벼에 발생하는 다양한 곰팡이 및 세균 병들에 대한 생물 방제제로 사용가능성이 보고되었는데, 특히 벼도열병, 벼 잎집무늬마름병, 벼 흰잎마름병, 벼 깨씨무늬병 및 벼 키다리병을 방제하는 것으로 보고되었다. 이 리뷰에서는 벼에 발생하는 다양한 병에 대한 생물 방제제로서 미생물들이 적용된 연구들에 대하여 논의하였다.
Trans Abstract
Rice is responsible for the stable crop of 3 billion people worldwide, about half of Asian depends on it, and rice is grown in more than 100 countries. Rice diseases can lead to devastating economic loss by decreasing yield production, disturbing a stable food supply and demand chain. The most commonly used method to control rice disease is chemical control. However, misuse of chemical control can cause environmental pollution, residual toxicity, and the emergence of chemical-resistant pathogens, the deterioration of soil quality, and the destruction of biodiversity. In order to control rice diseases, research on alternative biocontrol is actively pursued including microorganism-oriented biocontrol agents. Microbial agents control plant disease through competition with and antibiotic effects and parasitism against plant pathogens. Microorganisms isolated from the rice rhizosphere are studied comprehensively as biocontrol agents against rice pathogens. Bacillus sp., Pseudomonas sp., and Trichoderma sp. were reported to control rice diseases, such as blast, sheath blight, bacterial leaf blight, brown spot, and bakanae diseases. Here we reviewed the microorganisms that are studied as biocontrol agents against rice diseases.
서 론
벼는 전 세계 인구 절반에 해당하는 30억 인구의 주식으로, 특히 전체 아시아 인구의 절반이 벼를 주식으로 식용하고 있다. 실제로 전 세계 100개국 이상에서 벼를 재배하는 것으로 보고 되고있어(Kyndt 등, 2014; Skamnioti와 Gurr, 2009), 만약 직접적인 생산량 감소로 이어질 가능성이 높은 병해충이 대 발생할 경우 심각한 경제적 피해 뿐만 아니라 세계 식량 생산 및 수급 체계를 교란시킬 가능성이 높다(Chaiharn et al., 2009).
이러한 벼의 병해충 중 곰팡이 및 세균에 의한 병의 경우 azypxytrobin, benomyl, carbendazim, carpropamid, dithiocarbamate, edifenphose, fenoxanil, tiadinil, tricyclazole, pyroquilon 및 probenazole 등을 포함한 다양한 합성 농약이 관행적으로 병 방제에 사용되고있다(Hirooka와 Ishii, 2013; Kato, 2001). 그러나 빈번한 농약의 사용은 농약 내성균의 출현과 더불어 잔류독성, 토양의 질 저하 및 생물 다양성 파괴와 같은 환경오염의 원인이 되고 있다(Suprapta, 2012; Yoon 등, 2013). 이러한 합성 농약 사용 감소를 위한 대안으로 유기농업에 대한 사회적 요구가 증가되고 있으며, 특히, 생물학적 방법을 이용한 병방제 연구가 최근 활발히 이루어지고 있다.
유기농업은 농업생태계의 건강, 생물의 다양성, 생물 순환 및 토양 생물 활동 증진을 위한 총체적 체계 농업을 의미한다. 유기농업이란 비료, 농약 등을 포함하는 합성된 화학 자재를 일체 사용하지 않고 유기물과 미생물 등 천연자원을 사용하여 안전한 농산물 생산과 농업생태계를 보전하는 농업이라 할 수 있다. 이러한 유기농업의 적용 분야는 토양관리부터 재배관리, 병해충 관리, 잡초 관리 및 수확 후 관리 까지를 포함한다.
현재 벼에 활용되고 있는 유기농업 예제로는 헤어리베치 등의 녹비를 이용하여 토양 관리를 수행하고(Park 등, 2001), 우렁이 또는 쌀겨를 이용하여 잡초를 방제하며(Cha 등, 2010), 병 저항성 품종 이용과 유용미생물 혼합배양액과 석회보르도액을 혼용하여 병해를 방제하는 방식이 일반적으로 수행되고 있다(Lee 등, 2005).
유기농업의 또 다른 이점으로 농업 분야에서의 유기농 토양의 증가가 이산화탄소를 감축시켜 지구온난화를 줄일 수 있다고 보고되었다(Navarro-Pedreño 등, 2021; Paustian 등, 2019). 근래 전 세계는 폭우와 홍수, 가뭄이나 폭염 등 지구온난화에 따른 기상이변이 빈발하고 있다. 세계경제포럼(The World Economic Forum)은 ‘2021 세계위험보고서’에서 금후 10년을 위협할 가장 큰 요인으로 코로나19 같은 감염병 확산 다음으로 기상이변을 지구의 가장 큰 위험으로 선정하였다. 따라서 여러 산업분야에서 지구 온난화를 줄이기 위한 노력들을 기울이고 있으며, 특히 농업 분야에서는 유엔 세계식량기구(Food and Agriculture Organization of the United Nations, UN FAO)를 중심으로 기후스마트농업(Climate Smart Agriculture)을 통해 지구온난화에 대한 적응 및 온실가스 감축을 적극적으로 시도하고 있다. 기후스마트농업 기술 중 하나가 바로 유기농 토양의 적극적인 사용을 통해 토양 내에 보다 많은 이산화탄소를 격리(carbon sequestration)시키는 방법이다(Navarro-Pedreño 등, 2021; Paustian 등, 2019). 따라서, 본 리뷰에서 다룰 미생물을 활용한 친환경적인 벼 병해 방제법은 탄소의 배출을 줄임으로써 직간접적으로 지구온난화에 의한 기상이변을 줄이는 데 기여할 수 있을 것이다.
화학농약의 대체제로서 유기농업에 가장 많이 사용되는 방법으로 미생물제제를 들 수 있다. 미생물제제의 대부분은 농업 환경 혹은 토양에서 유래하는 곰팡이 및 세균 종들을 들 수 있다. 가장 많이 사용되는 미생물로 Trichoderma속(69 isolates), Glomus속(89 isolates), Pseudomonas속 (165 isolates), Peanibacillus속 (12 isolates), Streptomyces속 (122 isolates) 및 Bacillus속 (27 isolates) 등이 보고되었다. 미생물제제는 이러한 곰팡이와 세균을 포함하는 미생물을 이용하여 식물에 병을 일으키는 병원균과의 경쟁, 항균작용 및 기생을 통해 식물병을 제어하는 방법이다(Montesinos, 2003; Pala와 Mcspadden Gardener, 2006). 이 방법은 합성농약에 비해 안전하고 환경 친화적인 방법으로 식물병을 제어할 수 있어 활발한 연구가 진행되고 있다.
그러나 현재 미생물제제를 이용한 생물학적 작물 보호제 시장은 화학 보호제 시장에 비해 규모가 작으며, 화학 보호제에 비해 작용기작 및 지속성에 문제점을 갖고 있다. 이러한 문제점에도 불구하고 앞으로 무기농업에서 유기농업으로의 전환을 기대하는 사회적 요구에 따라 관련된 연구가 지속적으로 증가하고 관련 시장 역시 점차 성장할 것으로 예상된다.
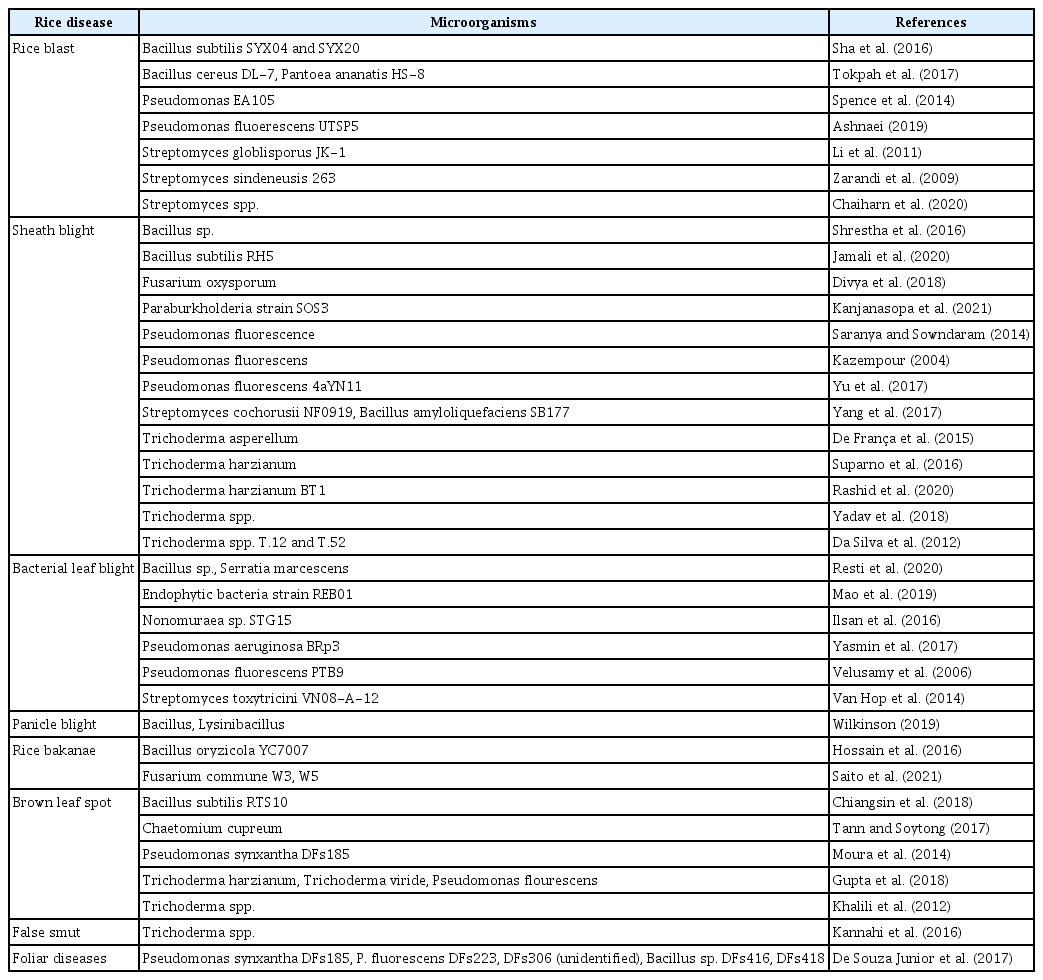
벼에 발생하는 주요병으로는 (1) 벼 도열병, (2) 벼 잎집무늬마름병, (3) 벼 흰잎마름병 및 (4) 벼 키다리병 등이 있는데, 최근 벼에 발생하는 병들을 유용미생물을 적용하여 방제하고자 하는 연구가 다양하게 진행되고 있다. 벼 발생 병을 방제 하고자 개발된 미생물제제는 주로 종자 침지, 종자 코팅, 상토 혼합, 엽면 살포 및 토양 살포 방법 등으로 통해 적용되고 있다. 본 리뷰에서는 벼의 중요한 병 방제를 위해 개발된 다양한 생물적 방제제에 대한 정보를 제공하고자 한다. 이러한 주요 병에 방제능을 보이는 미생물에 대한 보고를 Table 1에 정리하였다.
벼 도열병(Rice Blast, Magnaporthe oryzae)
벼 도열병의 원인 병원균은 Magnaporthe oryzae로 벼를 재배하는 모든 지역에서 문제가 되는 병으로 우호적인 환경조건과 병원균의 병원력이 강력하고 또한 기주가 감수성이라면 벼 재배지를 초토화시킬 만큼 심각한 병으로, 합성 농약이 가장 일반적으로 사용되고 있는 병이다. 따라서 최근에는 벼 도열병에 대한 합성 농약의 사용을 최소화하기 위해 친환경적 방제 기법을 개발하고자 다양한 연구가 이루어지고 있다.
Bacillus spp. 및 Pantoae ananatis. Sha 등(2016)은 벼 잎에서 분리한 Bacillus subtilis SYX04와 SYX20엽권 미생물들이 벼 도열병 균주 P131의 포자 발아와 부착기 형성을 억제하여 벼 도열병 발생을 저해한다고 보고하였다. 이러한 억제효과의 기작을 밝히기 위해 B. subtilis SYX04와 SYX20 미생물들을 벼 도열병 균주 P131과 함께 벼에 처리한 뒤 기주식물인 벼의 방어 기작과 관련된 효소들인 peroxidase, polyphenol oxidase 및 superoxide dismutase의 발현율을 비교했을 때, 벼 도열병 균주 P131만 처리한 것보다 높은 발현을 보여, 두 가지 처리 미생물들이 벼의 방어 기작을 증진시켜 벼 도열병의 병 발생 억제 효과를 나타내는 것이라고 보고하였다(Sha 등, 2016).
벼에서 분리된 Bacillus cereus DL-7과 Pantoea ananatis HS-8 미생물들 역시 벼 재배실험에서 각각 86.5%와 84%의 벼 도열병 방제가를 보였는데(Tokpah 등, 2017), 이 미생물들은 벼 도열병균의 부착기 형성에는 억제효과가 없었다.
Psudomonas spp. 및 Pantoae spp. Ashnae (2019)는 벼 근권에서 분리한 Pseudomonas fluorescence UTSP5 미생물을 이용하여 벼 도열병균의 방제효과를 검정하였다. 실험은 온실에서 이루어졌는데, 실험 결과 처리구에서 벼 도열병의 발생이 억제되었으며, 그 기작으로 적용 미생물에 의해 벼의 인산가용 능력이 증진되었기 때문인 것으로 보고하였다.
또 다른 연구에서는 벼 도열병 방제를 위해 근권미생물 Pseudomonas sp. EA105 및 Pantoea agglomerans EA106 균주들의 미생물 제제로서의 가능성을 실험을 통해 증명하였다(Spence 등, 2014). 미생물을 처리하지 않은 대조구와 비교했을 때, Pseudomonas sp. EA105를 처리한 처리구는 벼 도열병 발생이 33% 그리고 P. agglomerans EA106의 경우 46%가 각각 감소되어 벼 도열병의 생물학적 방제제로서의 가능성을 제시하였다. 벼 도열병균의 병진전을 억제하는 기작으로 Spence등은 이 근권 미생물이 벼의 jasmonic acid (JA) 저항성 관련 유전자인 JAR1과 WRKY30, ethylene (ET) 관련 유전자인 EIL1과 ERF1을 상향 조절함으로써, JA와 ET 의존적 유도 저항성(induced systemic resistance)을 촉진시키기 때문이라고 보고하였다.
Streptomyces spp. 벼 근권에서 분리한 근권미생물을 이용한 벼 도열병 방제 연구가 보고되었다. 이 연구에서는 근권에서 분리한 Streptomyces sp.를 적용한 실험을 온실에서 실시하였는데, 벼 도열병 병원균을 처리한 벼에서 87.5%의 벼 도열병이 발생한 반면, Streptomyces sp.를 벼 도열병균과 함께 처리한 실험구에서는 31.4-51.9%의 벼 도열병이 발생되어 무처리구에 비해 병 발생 진행이 늦어져 병 방제효과가 있음을 보고하였다(Chaiharn 등, 2020).
또한 벼 근권에서 분리한 Streptomyces sindeneusis isolate 263을 3엽기의 벼에 처리한 결과, 벼 도열병균만을 처리한 벼에서 발병 정도가 8로 높게 나타난 반면 근권 미생물을 처리한 실험구에서는 벼 도열병 발생 정도가 발병 정도 0.5로 현저히 낮아진 결과를 기술하여, S. sindeneusis isolate 263이 생물방제제로서 가능하다고 보고하였다(Zarandi 등, 2009).
미생물제제와 화학살균제를 비교한 벼 도열병 방제 연구도 시도되었다(Li 등, 2011). 벼에 도열병균을 접종한 뒤 5일이 지난 벼에 미생물 Streptomyces globisporus JK-1과 살균제 tricyclazole을 각각 처리했을 때, 미생물제제는 88.3%, 살균제는 79.4%의 방제가를 보여, S. globisporus JK-1 균주가 벼 도열병 방제에 주로 사용되는 Tricyclazole보다 우수한 방제 효과를 보인다고 보고하였다(Li 등, 2011). 그러나 Streptomyces globisporus JK-1 균주가 어떠한 기작에 의해 병 방제효과를 보이는지에 대한 기작 연구는 다루지 않았다.
벼 잎집무늬마름병(Sheath Blight, Rhizoctonia solani)
벼 잎집무늬마름병은 전 세계적으로 벼에 가장 경제적인 피해를 입히는 병 중 하나로, 곰팡이 병원균인 Rhizoctonia solani가 원인 병원균이다. 이 병의 전형적인 증상으로는 벼의 잎과 잎자루에 회백색의 내부와 짙은 갈색으로의 타원형의 불규칙한 병반이 생기는 병으로, 기주범위가 넓고 토양을 매개로 하는 병원균이다. 이 병은 주로 온대 및 열대의 벼 재배 지역에서 발생한다. 특히, 높은 질소 비료를 시용했을 때와 식물의 밀도가 높을 때 발생한다.
Bacillus sp. 벼 내생균 Bacillus-type rice-associated bacteria (RAB) 미생물을 이용하여 벼 잎집무늬마름병과 벼 알마름병 억제 연구도 보고되었다. 이 연구에서는 벼 잎집무늬마름병원균 Rhizoctonia solani와 알마름병원균 Burkholderia glumae 처리 24시간 후 Bacillus-type RAB 배양액을 살포한 결과, 잎집무늬마름병과 알마름병이 현저히 감소하는 결과를 보여 RAB의 가능성을 보고하였다(Shrestha 등, 2016).
Pseudomonas spp. 벼 잎집무늬마름병을 방제하기 위해, 벼 근권 미생물 Pseudomonas fluorescens B41를 이용하여 (1) 종자 침자, (2) 토양 적용 및 (3) 엽면 살포 방법을 벼 재배 포장에 적용한 연구도 보고되었다. 이 실험 결과 잎집무늬마름병의 억제 정도는 무처리구의 병 발병 정도인 52%와 비교했을 때 (1) P. fluorescens B41 종자처리 시험구 28%, (2) 토양적용 시험구 32%, (3) 엽면살포 시험구에서 22%의 병 발병 정도를 보여 무처리구보다도 모든 처리구에서 현저하게 병이 감소된 결과를 보고하였다(Kazempour, 2004). 이 결과에서 Kazempour는 P. fluorescens B41 엽면 살포 처리구에서 토양병원균인 벼 잎집무늬마름병(R. solani) 방제에 상대적으로 높은 방제효과가 나타난 이유로 근권과 엽권에 존재하는 P. fluorescens가 우점하기 때문인 것으로 보고하였다.
Streptomyces spp. 벼 잎집무늬마름병 방제를 위해 Streptomyces cochorusii NF0919의 배양 여액 추출물과 Bacillus amyloliquefaciens SB177의 배양액을 벼 재배구에 처리했을 때 벼 잎집무늬마름병의 방제가가 각각 78.4-98.1% 및 71.1-94.2%로 높은 방제가를 보인 연구결과가 보고된 바 있다(Yang 등, 2017).
Trichoderma spp. De França 등(2015)은 잎집무늬마름병 방제를 위해 Trichoderma asperellum을 벼 엽면에 살포하여 무처리구에 비해 병이 27% 줄어든 것을 관찰하였으며, 생산량은 26% 증가했다고 보고하였다. Da Silva 등(2012)은 Trichoderma spp.의 적용범위를 넓혀 (1) 발생 전 예방적 살포, (2) 종자 처리 및 (3) 병 발생 후 옆면 살포로 처리구를 나누어 적용 실험을 실시한 결과, 발생 전 예방적 살포에서 무처리구와 비교하여 65%의 방제가를 보여 처리시기별 실험에서 예방 살포가 가장 높은 방제효과를 보인다고 기술하였다.
또한 벼 잎집무늬마름병균을 벼에 인공 접종한 뒤 21일이 경과한 시점에 Trichoderma harzianum BT1을 엽면 살포한 결과, 89%의 높은 병 발생 감소율을 보여 T. harzianum BT1의 생물작용제로서의 가능성이 보고되었다(Rashid 등, 2020).
벼 흰잎마름병균(Bacterial Leaf Blight, Xanthomonas oryzae pv. oryzae)
벼 흰잎마름병은 Xanthomonas oryzae pv. oryzae가 원인병원균으로 영명으로 bacterial leaf blight (BLB)라 한다. 전 세계적으로 다양한 벼 품종에 널리 퍼져있는 병으로, 역사적으로 BLB는 1884-1885년 일본에서 처음 보고된 후 다른 벼 재배국가에서도 빈번하게 보고되고 있다(Gnanamanickam, 2009). 벼는 특히 집중호우가 내리는 열대지방 및 아열대지역을 중심으로 심각한 수준의 병이 발생하는 것으로 알려져 있다. BLB를 방제하기 위해 사용되는 항생제 및 화학물질은 새로운 레이스 변이를 일으키는 원인이 되므로 지속적인 사용에는 한계가 있기 때문에 최근 다양한 생물학적 방제제에 관한 연구가 다각적으로 이루어지고 있다.
Bacillus spp. 내생균 Bacillus sp. SJI와 Bacillus sp. HI 배양 혼합액에 종자를 침지하였을 때 벼 흰잎마름병 발생 정도가 6.78%로 무처리구의 18%에 비해 감소하는 결과가 나타났으며, Streptomyces toxyricini VN08-A-12의 경우와 마찬가지로 벼의 생육이 증가되는 결과가 관찰되었다(Resti 등, 2020).
Nonomuraea sp. 최근 기후변화에 의해 기온이 증가하면서 남부지방을 중심으로 발생하는 X. oryzae pv. oryzae에 의한 벼 흰잎마름병 방제를 위한 미생물제제 연구가 보고되었다. 이 병을 방제하기 위해 온실 환경에서 벼의 엽권에서 분리한 Nonomuraea sp. STG1을 처리 했을 때 벼 흰잎마름병에 대해 25.9%의 방제가를 보였고(Ilsan 등, 2016), 벼 종자를 Pseudomonas aeruginosa BRp3 (1×109 cfu/ml)의 배양액에 30분간 침지시킨 후 재배한 결과 무처리구에서 83.0%의 벼 흰잎마름병의 발병을 보였다. 반면 P. aeruginosa BRp3 균주를 종자에 도포하는 방식으로 처리한 처리구에서 43%의 발병률을 보였고 항생제 처리구에서는 39%의 발병률을 보여, P. aeruginosa BRp3가 벼 흰잎마름병을 억제하는 것으로 나타났다(Yasmin 등, 2017). 또한 재배포장에 적용하였을 때 수확량이 관행구보다 증가하는 결과로부터 P. aeruginosa BRp3의 생장 증가(growth promotion) 효과도 보고되었다(Yasmin 등, 2017).
Streptomyces spp. 벼 흰잎마름병을 유도한 시험구에 Streptomyces toxytricini VN08-A-12 배양액을 옆면 살포 처리하였을 때, 대조구에 비해 32.6-38.3%의 병 발생 감소를 보였고, 수확량의 경우 증가하는 결과를 보였다(Van Hop 등, 2014).
벼 깨씨무늬병(Brown Leaf Spot, Bipolaris oryzae)
벼 깨씨무늬병은 원인 병원균이 Bipolaris oryzae로 완전세대는 Cochliobolus miyabeanus이며 종자 발아 동안 대발생하여 논의 유묘가 죽는 큰 경제적인 피해를 입을 수 있다. 특히, 감수성 품종의 사용이 증가하고있어 벼 깨씨무늬병의 발생이 일부 지역에서 증가하고 있다. 또한 벼 깨씨무늬병균은 꽃의 불임을 증가시킬 수도 있으며, 심할 경우 벼알에 감염하여 얼룩진 곡물의 발생을 증가시키기도 한다.
Bacillus sp. Chiangsin 등(2018)의 보고에 따르면 미생물 Bacillus subtilis가 Bipolaris oryzae의 생장을 억제하고, 종자 처리시 벼 깨씨무늬병이 억제된다고 보고하였다. B. subtilis 배양액에 부착제의 일종인 polyvinylpyrrolidone와 talc를 섞어 제형화하여 기간에 따른 방제가를 살펴 본 결과, 깨씨무늬병이 3개월 저장했을 때 94.3%, 6개월 저장했을 때는 72.3%을 보여 살균제인 mancozeb을 처리했을 때보다 높은 방제가를 보인다고 보고하였다(Chiangsin 등, 2018). 또 다른 연구에서 Moura 등(2014)은 볍씨를 미생물배양액에 침지시킨 후 파종하여 병 발생 정도를 관찰하였는데, 그 결과 Pseudomonas synxantha DFs185가 벼 깨씨무늬병을 78.9% 저감시킨다고 보고하였다.
Chaetomium cupreum. 벼 깨씨무늬병 방제를 위해 미생물을 적용하는 연구결과도 꾸준히 보고되고 있다. Tann과 Soytong (2016)은 벼 깨씨무늬병원균을 벼에 처리하여 병을 유도한 후 Chaetomium cupreum 포자액을 1×106/ml 포자수로 추수 전 15일 간격으로 살포한 결과, 75.9%의 벼 깨씨무늬병 방제가를 나타낸다고 보고하였다.
Trichoderma sp. Trichoderma harzianum 역시 벼 깨씨무늬병 방제에 적용 가능성을 시사하는 연구 결과가 보고되었는데, 벼 깨씨무늬 병징이 나타난 벼 잎에 T. harzianum을 엽면 살포했을 때 벼 깨씨무늬병이 억제되는 결과가 보고되었다(Gupta 등, 2018; Khalili 등, 2012).
벼 키다리병 (Bakanae Disease, Fusarium fujikuroi)
벼 키다리병의 원인 병원균은 Fusarium fujikuroi로 한국, 중국, 인도 및 방글라데시를 포함하여 주요 벼 재배 지역에서 3%에서 80%까지의 발생률을 기록한 바 있다(Mew와 Gonzales, 2002). 벼 키다리병은 종자 및 토양에 의해 매개되는 것으로 알려져 있으며 병에 걸린 기주 식물체의 잔재에서 월동하는 것으로 알려져 있다. 병징은 비 정상적으로 길게 자란 모종 또는 모종의 부패 등이 있다. 벼 키다리병의 방제를 위해 지금까지는 합성 농약을 이용한 종자 소독을 비롯하여 뜨거운 물(50-55oC)에서 처리하는 방식을 사용하였지만, 최근에는 생물학적인 방제제의 개발이 이루어지고 있다.
Bacillus oryzicola. 벼 키다리병 방제를 위해 Bacillus균을 적용한 방제 연구가 수행되었다(Hossain 등, 2016). Hossain 등(2016)은 벼 육묘의 뿌리를 Bacillus oryzicola YC7007 배양액에 침지하여 화분에 옮겨 심은 뒤 10일이 경과한 뒤 벼 키다리병을 조사한 결과, 벼키다리병이 78%까지감소되었다고보고하였다.
화학 제제와 B. oryzicola YC7007 배양액에 종자 소독을 하여 벼 키다리병 감소율을 비교한 결과, 화학 제제 prochloraz와 fludioxonil 혼합제에 종자를 소독하였을 때 55.6%의 감소율을 보인 반면, B. oryzocola YC7007 종자 소독 시험구는 66.7%의 감소율을 보였다. 이러한 병 감소율은 아마도 B. oryzocola YC7007이 기주에 H2O2를 축적시켜 활성산소 특이적 방어기재(reactive oxygen species-mediated defense mechanisms)를 일으키기 때문인 것으로 보고하였다(Hossain 등, 2016; Niu 등, 2011).
Fusarium commune. Fusarium fujikuroi에 의해 발병하는 벼 키다리병을 방제하기 위해, 벼 키다리병의 생활사를 모방하여 벼에 병원성이 없는 F. commune W5를 우선적으로 선점하여 예방하는 방법이 Saito 등(2021)에 의해 보고되었다. 이 방법은 비병원성 Fusarium을 벼의 개화기에 살포하여 종자 감염을 시도하여 병원균과 비병원균의 경쟁을 유도하는 방법으로, 비병원성 Fusarium 적용 결과 이듬해 벼 키다리병의 방제가가 66.4-91.2%까지 나타났다.
결 론
벼에 발생하는 병 방제에는 화학농약 사용이 주로 이루어져 왔다. 최근에는 국가차원에서 화학농약의 대체체에 대한 연구가 활발히 진행되고 있으며, 특히 미생물을 이용한 친환경적 방법이 주목 받고 있다.
저렴하고 오래 지속되며 환경에 안전하지만 화학농약 보다 방제효과가 지속적으로 나타나고 효과가 좋은 미생물제제를 개발하기 위해서는 상당한 시간과 노력이 필요하다. Bacillus sp., Pseudomonas sp. 및 Trichoderma sp.가 주로 미생물제제 개발에 이용되고 있고, 방제 효과 또한 높게 나타나고 있다. 그러나, 실험실 및 온실 내에서의 효과보다는 벼 재배 포장에서의 방제력 평가가 선행되어야 할 것이고, 제제화시키기 위해서는 제형 연구와 적용 방법 연구가 더 필요하다.
2021년 현재 우리나라에 벼 병해충 대상 미생물 농약, 즉 천연식물보호제는 7종이 등록되어 유통되고 있고, 식물추출물, 미생물 등의 벼 병해충 관리용 유기농업자재는 200여 종 넘게 공시되어 사용되고 있다(국립농산물품질관리원, 유기농업자재 목록공시). 그러나 국내 친환경농산물 재배 농가수와 재배 면적은 2012년 이후로 감소세를 보이고 있으며, 또한 2018년 친환경농산물 시장규모는 1조 2,868억원 수준으로 2012년 이후 감소세를 보이고 있다(Chung 등, 2019). 현재 정부 주도적으로 친환경학교급식을 확대하는 방향으로 가고 있음에도 불구하고, 젊은 층의 친환경농산물 인지도가 타 연령층에 비해 낮을 뿐만 아니라 친환경 농산물의 높은 가격으로 인해 소비자로부터 외면을 받는 것이 현실이다. 따라서 건강한 먹거리 생산의 중요성을 환경 친화적인 측면에서 홍보해야 할 것이다.
우리나라 정부는 ‘2050 탄소중립’을 선언했는데, 온실가스를 줄이고 탄소중립 목표를 달성하기 위해, 농촌의 공익적인 역할이라는 관점에서 친환경사업화는 가속화되어야 할 것이다.
Notes
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.
Acknowledgements
This work was supported by a grant from the Rural Development Administration (PJ0152782020).