서 론
20세기 인류는 산업화에 따른 사회·경제적인 발전을 이루었고, 이는 화석연료의 이용을 통해 가능했다. 화석연료는 제한된 매장지역과 매장량으로 인해 여러 차례 세계경제 위기의 원인으로 지적되었다. 무분별한 화석연료의 사용은 막대한 온실가스를 발생시켜 지구온난화와 같은 다양한 환경문제를 야기했다(Pittman 등, 2011). 대기 중 CO2 농도는 1750년 이후 30% 정도 증가하여 현재 400 ppm 이상으로 확인된다. 그러나, Representative Concentration Pathway (RCP) scenario 4.5, 6.0, 8.0에 따르면 2100년 지구 평균 CO2 농도는 각각 540 ppm, 670 ppm, 940 ppm이 될 것으로 예측하고 있다(Jones 등, 2016). 미국해양기상청(National Oceanic and Atmospheric Administration, NOAA)은 2015년 3월 지구 CO2 농도가 400.83 ppm으로 400 ppm을 넘었다고 발표하였다. 한국은 안면도 기후변화감시소 CO2 관측 결과 2012년 399.9 ppm, 2013년 402.9 ppm, 2016년 409 ppm으로 매년 평균 2.09 ppm씩 증가하는 추세를 확인하였다(Korea Meteorological Administration, 2017).
온도는 지리적 분포와 식물의 생존을 결정하는 요인 중 하나이며, 각 식물체는 생장 및 발달에 필요한 최적 온도 범위를 가지고 있으며, 그 한계를 넘으면 고사한다(Xu 등, 2012). 일반적으로 온도 증가는 식물의 생장 기간을 연장시키고, 질소의 무기물화를 증가시켜 수목의 생장을 촉진한다고 알려졌다 (Kilpeläinen 2003). 그러나, 온도 상승에 대한 실험적 연구와 모델 연구에 따르면 온난화에 의한 식물의 생장은 수종에 따라 다양한 반응을 보였다(Barber 등, 2000; Danby 와 Hik, 2006; Volder 등, 2004).
또한, 온난화는 기온변화 이외에도 토양수분 함량에 영향을 미치는 것으로 알려져 있으며, 온난화에 대한 식물의 생장 반응이 건조 스트레스에 영향을 주기도 한다(Rustad 등, 2001; Yin 등, 2008). 건조 스트레스는 식물의 생산성을 제한하는 주요 원인으로 뿌리에 공급되는 수분이 부족하거나 증산속도가 빠를 경우 발생한다. 건조스트레스로 인한 식물의 생장 감소는 잎에서의 수분함량과 잎의 수분포텐셜이 감소함에 따라 광합성 속도와 효율이 감소하기 때문에 식물의 생산량 감소로 이어진다(Chaves 와 Oliveira, 2004; Lawlor, 2002; Lawlor 와 Cornic, 2002; Lawson 등, 2003).
고추(Capsicum annuum L.)는 중부아메리카 원산지로 국내는 17세기 초 전래되어 현재까지 재배되는 채소이며 2017년 국내 재배면적 28,337 ha, 생산량 55,714 ton으로 조미채소 중 가장 많은 생산량과 경제적 규모를 가지는 매우 중요한 작물이다(Statistics Korea, 2018). 고추에 세균점무늬병을 일으키는 Xan-thomonas euvesicatoria는 식물체의 각 부분에 발병하지만 주로 잎에 황녹색의 점무늬를 나타내며 병반이 점차 확대되며 잎 전체가 황화되어 조기 낙엽을 유발한다.
온난화에 따른 기온상승은 식물 병원성 미생물의 발병력과 식물체의 저항성에 영향을 줄 수 있을 것이며, 미생물과 식물체 간의 상호작용에도 영향을 미칠 것으로 예상된다. 온도와 토양 수분은 식물에 직접적으로 영향을 미칠 수 있는 비생물학적 요소이며, 식물병원성 미생물에도 직·간접적인 영향이 보고되었다 (Coakley 등, 1999; Manning과 Tiedemann, 1995). 1990년대부터 영국, 미국, 독일을 비롯한 많은 나라에서 CO2 증가와 병원성 미생물에 대한 연구를 보고하였으나 복합적 비생물학적 요인에 기인한 병원균과 식물병간 상관성에 대한 연구는 매우 부족한 실정이다 (Chakraborty 등, 2008; Mitchell과 Zentmyer, 1971; Percy 등, 2002).
본 연구는 고온과 건조가 지속되는 복합 환경에서 고추 병원균과 식물간의 상호작용을 확인하고자 하였다. 고추와 고추 세균점무늬병 병원균 X. euvesicatoria를 이용하였으며, 각각의 환경에 따른 고추 내의 병저항성 관련 유전자의 발현양상을 quantitative real-time PCR (qRT-PCR)로 분석하였다. 본 연구를 통해 미래의 변화된 환경에서 한국의 주요 경제작물인 고추와 고추의 주요피해 병원균인 X. euvesicatoria의 발병양상을 이해하는데 필요한 기초자료를 제공할 것으로 기대된다.
재료 및 방법
식물 및 미생물
본 실험에서 사용한 고추(Capsicum annuum L.)는 N사의 천년약속고추 종자를 구입하여 사용하였다. 각 종자는 유리온실 내에서 육묘용 상토가 담긴 72공 포트에 파종 후 25°C, 매일 수분을 충분히 공급하여 발아시켰으며, 4엽이 되었을 때 지름 9 cm의 포트에 옮겨 심었다. 고추에 세균점무늬병을 일으키는 병원균인 Xanthomonas euvesicatoria KACC 18722는 25% glycerol stock 상태로 -80°C에 보관하며 이를 사용하였다.
병원균 접종 및 고추의 생장 조건
병원균은 6주 된 천년 약속고추에 접종하였다. X. euvesicatoria는 tryptic soy broth (TSB) 배지에 접종하여 30°C에서 24시간 진탕 배양하였다. 최종 병원균의 양은 TSB 배양액으로부터 원심분리한 후 상등액을 제거하고, DW로 세척하여 108 cfu/ml이 되게 희석한 후 분무기를 이용하여 식물체에 접종하였다. 각 pot의 배양조건은 온도는 25°C, 30°C와 35°C로 유지하고, 토양 수분 조건은 -30 kPa와 -150 kPa로 유지시켰으며 시험구 식물체는 20개로 각 조건별 3반복하여 배양하였다. CO2 의 농도는 각각 400 ppm이 유지되는 생장상에서 L/D cycle은 16/8, 광량은 400 µmol/m2/sec로 실 험을 수행하였다. 또한 생장상의 병 접종 후 24시간 뒤 유전자 분석을 위한 시료를 채취하였다. 토양수분측정은 적외선수분 측정기(MS-70)를 이용하여 측정하였으며, 모든 실험은 온도, 습도, 광원의 세기 및 CO2 농도가 자동 조절되는 배양챔버(2 m××2.5 m×2 m)에서 식물체를 배양하였다.
Total RNA 추출 및 cDNA 합성
X. euvesicatoria 접종 24시간 후 고추 잎을 액체 질소에 얼려 분쇄한 후, RNeasy Mini Kit (Qiagen, Hilden, Germany)를 이용하여 total RNA를 추출하였다. 추출한 RNA는 NanoDrop ND-2000 (Thermo Fisher Scientific, Waltham, MA, USA)으로 정량하였다. cDNA합성은 1 µg 의 RNA와 1 µl oligo dT (100 pmol/l)를 혼합 후, DEPC-treated distilled water로 전체 부피를 16 µl로 맞춘 뒤, 70°C에서 5분간 처리하였다. 이후, 5× reverse transcription master mix (Biofact)를 4 µl 첨가하고, 42°C에서 90분, 94°C에 서 5분간 반응하여 cDNA를 합성하였다.
qRT-PCR에 의한 병 관련 유전자 분석
병 관련 유전자 분석을 위한 primer는 NCBI에 등록되어 있는 유전정보를 활용하여 primer3 (http://primer3.ut.ee/)를 이용하여 설계하였다(Table 1). qRT-PCR 분석을 위한 standard clone은 설계된 primer를 이용하여 PCR한 후, 각각 PCR 산물을 All-in-one vector (Biofact)에 cloning한 후, plasmid DNA는 HiGene Plasmid Mini Prep Kit (Biofact)를 이용하여 추출하여 염기서열을 결정하였다. 염기서열 분석은 All-in-one Vector systems manual에 따라 M13-20F와 M13-20R primer를 이용하여 분석하였고, BLAST search를 통해 확인하였다. 염기서열이 확인 된 plasmid DNA 는 real-time PCR (Bio-Rad, Hercules, CA, USA)을 이용하여 melting curve 분석 후 정량분석을 위한 표준 유전자(artificial standard clone)로 사용하였다.
Table 1
Nucleic acid sequence of oligonucleotide primers used qRT-PCR assay for the disease resistance gene of Capsicum annuum L. in this study
정량 PCR은 CFX96 Touch Real-Time PCR Detection System (Bio-Rad)과 QuantiFast SYBR Green PCR Kit (Qiagen)을 이용하였다. 각 유전자의 정량 PCR은 앞에서 설계한 각각의 primer를 이용하였으며(Table 1), 반응조건은 95°C에서 15분 동안 pre-denaturation 시켜, 95°C에서 30초 denaturation, 각 유전자 별로 30초 annealing, 72°C에서 30초 extension후 fluorescence intensity를 측정하고 45 cycles을 수행하였다. CaLRR1, CaPIK1, CaPR10, CaWRKY1 유전자의 annealing 값은 각각 64.2°C, 62.6°C, 62.6°C 및 64.0°C이다. Final extension은 72°C에서 5분 동안 수행하였다. Melting curve 분석은 65°C부터 95°C까지 0.2°C씩 증가시키면서 fluorescence를 측정하였다.
각 유전자의 발현 양은 qRT-PCR을 수행하여 분석하였다. 정량을 위한 표준 유전자를 1 ng/µl부터 serial dilution하여 qRT-PCR을 3반복 수행하였으며, 분석하고자 하는 DNA 농도는 NanoDrop ND-2000 (Thermo Scientific)을 이용하여 1 ng/µl를 분석에 이용하였다 (Kim 등, 2017).
Total DNA 추출 및 X. euvesicatoria 정량
Total DNA는 Fast DNA Spin kit for Soil (MP Biomedicals, Solon, OH, USA)를 이용하여 추출하였으며, 추출된 DNA의 농도 및 순도는 NanoDrop ND-2000 (Thermo Scientific)을 이용하여 확인하였다. X. euvesicatoria 정량을 위 해 X. euvesicatoria의 xopP gene (AY756270)을 이용하여 primer를 제작하여 probe로 확인하였다(Table 1) (Jang 등, 2018).
발병 조사
온도 증가에 따른 따른 고추 세균점무늬병의 발병 양상을 확인하기 위해 X. euvesicatoria를 접종 후 7일 뒤 발병도를 확인하였다. 또한, 발병도 조사를 위한 시료는 각각 20개체 반복 수행하였다. 발병률은 발병엽수와 전체 엽수를 조사하여 백분율로 산출하였다. 발병도 조사는 각 잎의 병반 부위를 세어 0−4 (0, 병반 부위 없음; 1, 1−20개; 2, 21−40개; 3, 41−60개, 4; 61개 이상)로 발병 정도를 구분하여, 구분된 수의 평균값을 발병도로 정의하였다(Jang 등, 2018).
결과 및 고찰
식물의 온도와 토양 수분 복합스트레스의 영향 및 발병양상
온난화로 인한 작물 재배지의 온도 상승과 강수량 변화에 따라 식물의 생장에 영향이 있으며, 이에 따른 온도 증가 환경에서 식물체 병 저항성과 연관성이 보고되었다(Jang 등, 2018). 따라서 미래의 온도 증가 환경에서 고추 세균점무늬병의 발병과 이에 따른 식물체의 병 저항성 관련 유전자의 발현양상을 확인하고자 하였다. 현재 대기중 CO2 농도 400 ppm에서 25°C, 30°C, 35°C의 생장상에서 연구를 수행하였다.
고추에 세균점무늬병원균인 X. euvesicatoria를 접종하고, 7일 후 고추는 성장 적합환경인 -30 kPa에서 고추 성장이 저해되지 않는 것을 확인할 수 있었다. 또한 온도가 증가함에 따라 성장 속도가 증가하는데, 30°C의 고추 잎이 35°C 고추 잎보다 큰 것을 확인하였다. 그러나 건조 스트레스 환경인 -150 kPa에서 고추의 성장은 둔화되는 것을 확인하였고, 35°C 조건에서는 고사되는 것을 확인했다(Fig. 1). 온도 증가는 식물 생리작용에 영향을 주며, 다양한 반응을 유발한다고 보고되었다(Danby 와 Hik, 2006; Kilpeläinen 2003; Volder 등, 2004; Yin 등, 2008). 고추는 24시간 평균 온도가 24°C 이상으로 높아질 경우 호흡량이 증가하여 낙화 및 낙과율이 높아져 성장이 저해된다고 알려져 있다. 그리고, 동일한 온도에서 모두 건조 스트레스 환경에서 식물체의 성장이 더욱 저해되는 것을 확인하였다. 이를 통해 고추의 성장에 있어서 온도보다 토양 수분 함수량의 영향이 더 크다는 것을 알 수 있다.
Fig. 1
Comparison of red pepper grown under different temperatures and water conditions. Photographics were taken 7 days after combined drought stress and inoculation of X. euvesicatoria: 25°C (A), 30°C (B), and 35°C (C).

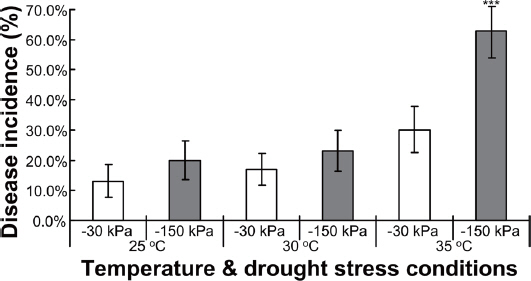
또한, 고추의 생장 조건에 따라 세균점무늬병원균인 X. euvesicatoria를 접종하고 7일 후 발병도를 확인한 결과는 Fig. 2와 Supplementary Table 1과 같다. -30 kPa 토양 수분포텐셜의 고추의 세균점무늬병 발병도는 25°C에서 13%, 30°C에서 17%, 35°C에서 30%로 발병도가 증가하며, 온도가 증가할수록 발병률도 증가하는 것을 확인하였다. 그리고, 각 25-30°C, 30-35°C의 온도구간별 발병도는 각각 4%와 13%로 온도가 높아질수록 증가폭이 상승하였다. 그리고, -150 kPa 토양 수분포텐셜의 고추의 세균점무늬병 발병도는 25°C에서 20%, 30°C에서 23%, 35°C에서 63%로 발병률이 매우 높게 증가하는 것으로 확인되었다. 또한, 각 25-30°C, 30-35°C의 온도구간별 발병도는 각각 3%와 40%로 나타났으며, 온도증가가 세균점무늬병의 발병률을 증가시키는 것을 확인하였다. 그리고, 동일한 온도 조건에서도 건조 스트레스를 받으면 세균점무늬병의 발병률이 증가하였다. 복합스트레스 환경조건에서 30°C에서 증가율은 4%에 그쳤으나, 고온 스트레스환경에서 발병 증가율은 13%인 것에 비해, 복합스트레스 환경인 35°C의 건조스트레스 환경에서는 40%의 발병률로 증가율이 매우 높아진다는 것을 확인할 수 있었다.
Fig. 2
Effect of water stress on disease incidance and severity by X. euvesicatoria. **P<0.05, ***P<0.01.
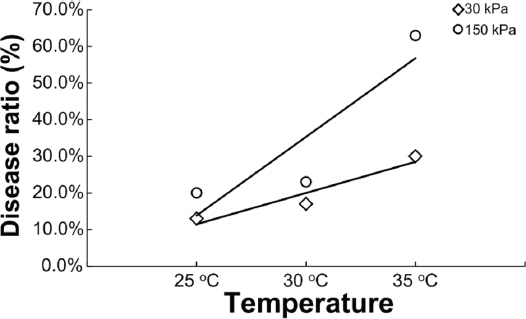
또한, 온도에 따른 건조 스트레스인 복합환경조건에서 발병률을 조사한 후 각 점들간의 추세선을 구했다(Fig. 3). -30 kPa 토양 수분포텐셜 조건에서 온도가 증가함에 따라 발생하는 세균점무늬병의 기울기보다 -150 kPa 토양 수분포텐셜 건조 스트레스 조건에서 온도가 증가함에 따라 발생되는 세균점무늬병의 기울기가 더욱 큰 것을 확인하였다. 이를 통해 향후 지구 온난화 환경에서 고추 세균점무늬병의 발병은 온도에 의한 영향보다는 토양 수분포텐셜에 의한 영향이 더 크다는 것을 추론할 수 있다. 한국에서 고추세균성점무늬병 연구는 X. campestris pv. vesicatoria에 관한 연구가 활발히 진행되었으며, X. euvesicatoria 연구는 2010년경 시작하여 연구 결과가 부족한 상황이나, X. campestris pv. vesicatoria는 온도와 CO2 증가와 같은 복합스트레스 환경에서 발병률간에 연관성을 주장하였으며, 본 연구화 유사한 것을 확인할 수 있다(Shin과 Yun, 2010). 현재까지 지구온난화에 의한 병원성 미생물과 식물간 상호작용 연구는 두 가지 관점에서 연구되었다. 먼저, CO2의 증가에 의한 식물 병원성 미생물의 변화를 연구하였다. Erysiphe graminis는 보리흰가루병원균으로 350 ppm 보다 700 ppm의 CO2에서 생장률이 높아졌으며(Hibberd 등, 1996), Stylosanthes scabra의 탄저병원균인 Collectotrichum gloeosporioides는 높은 CO2 농도에서 초기 생장이 지연되나 콜로니가 형성되면 빠르게 생장률이 높아진다고 보고되었다(Chakraborty 등, 2000). 다른 하나로 CO2 증가에 따른 식물의 변화로 인해 병원성 미생물에 대한 저항성의 변화를 규명하려는 연구가 진행되었다. CO2 700 ppm이 된 환경에서 식물의 defense structure인 papilla 형성 및 기공 밀도 감소에 의한 병원체의 침입 방지는 식물체의 내성 증가와 상관관계가 매우 높다고 보고되었다(Bettarini 등, 1998). 그러나, CO2 농도 증가는 식물병원체와 식물체에 다양한 변화를 준다는 것을 의미하며, 결론적으로 환경 요인이 어느 쪽으로 더 유리하게 작용하는가에 따라 결과가 달라질 수 있다는 것을 추측할 수 있다.
복합스트레스 환경에서의 고추 세균점무늬병원균의 정량분석
대기 중 온도 증가로 인한 환경에서 토양 수분포텐셜 -30 kPa와 -150 kPa에서 X. euvesicatoria를 접종하고 24시간 후 시료를 채취하여 X. euvesicatoria의 xopP gene (Fig. 4)과 고추의 병 저항성 유전자(CaLRR1, CaPIK1, CaPR10, CaWRKY1)의 발현양상을 정량 분석하였다(Fig. 5).
Fig. 4
Quantification of Xanthomonas euvesicatoria under different temperatures and water conditions by the real-time PCR. The real-time PCR was taken 24 hr after combined drought stress and inoculation of X. euvesicatoria.
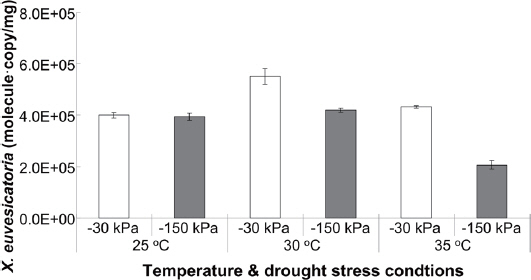
Fig. 5
Expression of disease resistance gene CaLRR1 (A), CaPIK1 (B), CaPR10 (C), and CaWRKY1 (D) in Capsicum annuum L. by Xanthomonas euvesicatoria. The quantitative real-time PCR was taken 24 hr after combined drought stress and inoculation of X. euvesicatoria. *P<0.1, **P<0.05, ***P<0.01.
고추 세균점무늬병원균인 X. euvesicatoria를 접종 후 초기량은 토양 수분포텐셜 -30 kPa과 -150 kPa에서 2.29×105±9.26×103 molecule·copy/mg 와 2.21×105±2.82×103 molecule·copy/mg 로 정량되었다(data not shown). 접종 24시간 후 처리구별로 xopP gene을 정량하였으며, 토양 수분포텐셜 -30 kPa 조건하 25°C, 30°C와 35°C에서 X. euvesicatoria는 3.39×105±1.09×104 molecule·copy/mg, 5.51×105±3.02×104 molecule·copy/mg, 4.32×103±4.76×103 molecule·copy/mg 로 확인되었다. 또한, 건조조건인 토양 수분포텐셜 -150 kPa 조건하 25°C, 30°C와 35°C에서 X. euvesicatoria는 3.94×105±1.29×104 molecule·copy/mg, 4.19×105±8.06×103 molecule·copy/mg, 2.07×105±1.64×104 molecule·copy/mg 로 각각 분석되었다 (Fig. 3).
토양 수분포텐셜 -30 kPa에서의 X. euvesicatoria의 성장은 4.0×105 molecule·copy/mg 수준에서 유지되었으며, 30°C에서 증가하는 것을 확인하였다. 그러나, 25°C와 30°C 처리구에서 X. euvesicatoria의 증가에 따른 고추 세균점무늬병의 발병률의 증가는 4%로 낮은 수치를 보였다(Supplementary Table 1). 하지만, 35°C에서 X. euvesicatoria는 4.0×105 molecule·copy/mg 수준을 유지하였으나, 고추 세균점무늬병의 발병률은 30%로 증가되었으며, 발병률 변화는 25°C보다 17% 높아진 것을 확인하였다. 그리고, 토양 수분포텐셜 -150 kPa에서의 X. euvesicatoria의 성장은 25°C와 30°C 조건에서 4.0×105 molecule·copy/mg 수준에서 유지되었으며, 35°C에서 2.0×105 molecule·copy/mg 수준으로 감소되었다. 건조 스트레스환경에서 X. euvesicatoria에 개체수에 따른 고추 세균점무늬병의 발병은 25°C와 30°C 조건에서 20% 정도로 비슷한 발병률을 확인하였다. 그러나 매우 특이적으로 35°C 조건에서 X. euvesicatoria에 개체수가 감소되나 고추 세균점무늬병의 발병률은 63%로 3배정도 증가하는 것을 확인하였다. 위 결과를 통해 X. euvesicatoria의 성장은 온도보다 토양 수분포텐셜이 더 크게 영향을 미치는 것을 확인하였다(Fig. 3, Supplementary Table 1). 그리고, X. euvesicatoria의 개체수와 고추 세균점무늬병의 발병관계가 비례관계에 있지 않음을 확인하였으며, 고추 세균점무늬병의 발병은 X. euvesicatoria의 개체수보다 배양 환경이 더 큰 영향을 미친다는 것을 확인하였다. 이것은 온도 증가에 따른 고온 및 건조스트레스 조건에서 X. euvesicatoria 내의 발병 관련 유전자가 과발현되거나 비생물학적 요인에 의해 고추 세균점무늬병 발병률이 증가한다는 가능성을 추측할 수 있다.
복합스트레스 환경에서의 식물체 내 식물병 관련 유전자의 정량분석
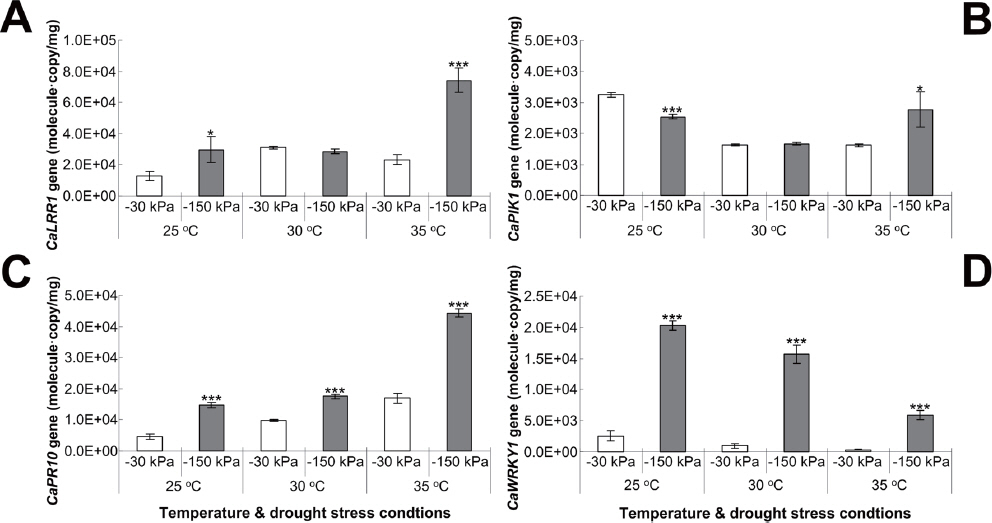
-30 kPa의 온도 25°C, 30°C, 35°C에서 CaLRR1 유전자 발현량은 1.29×104 molecule·copy/mg, 3.09×104 molecule·copy/mg, 2.33×104 molecule·copy/mg 로 각각 확인되었다. 그리고, 건조스트레스 조건인 -150 kPa에서 온도에 따른 유전자의 발현량은 2.96×104 molecule·copy/mg, 2.86×104 molecule·copy/mg, 7.41×104 molecule·copy/mg 로 각각 확인되었다(Fig. 5A, Fig. 5 Supplementary Table 2). CaLRR1 유전자 발현은 35°C와 토양 수분포텐셜 -150 kPa 환경에서 가장 높게 발현되는 것을 확인하였다. 또한 같은 온도의 -30 kPa환경에서 CaLRR1 유전자 발현은 다른 온도조건인 25°C, 30°C, 35°C에서 발현량과 유사한 것을 확인하였다. 이것은 X. campestris pv. vesicatoria에 의한 고추에서의 CaLRR1 유전자의 발현 연구에서 병원성 박테리아에 의한 식물체의 감염이 LRR 유전자의 발현에 관여한다고 보고된 결과와 유사하였으며(Hipskind 등, 1996), 고온 건조한 환경에서 X. euvesicatoria를 접종 시 CaLRR1의 발현이 증가되는 것을 확인하였다.
또한, CaPIK1 유전자 발현 양상을 확인한 결과, -30 kPa의 온도 25°C, 30°C, 35°C에서 CaPIK1 유전자 발현량은 3.24×103 molecule·copy/mg, 1.63×103 molecule·copy/mg, 1.61×103 molecule·copy/mg 로 각각 확인되었다. 그리고, 건조스트레스 조건인 -150 kPa에서 온도에 따른 유전자의 발현량은 각 온도당 2.54×103 molecule·copy/mg, 1.67×103 molecule·copy/mg, 2.77×103 molecule·copy/mg 로 각각 확인되었다(Fig. 5B, Fig. 5 Supplementary Table 2). CaPIK1은 receptor-like cytoplasmic protein kinase (RLCK)와 높은 유사성이 확인되었으며, 식물에서만 확인되는 단백질로 알려져 있다(Shiu와 Bleecker, 2001, 2003). 최근 보고에 따르면 X. campestris pv. vesicatoria에 의해 감염 초기 단계의 고추에서 높은 수준의 CaPIK1 유전자가 발현되었으며, 이것은 CaPIK1단백질이 병원균 침입에 대한 고추 식물의 방어 반응과 상관관계가 매우 높은 것을 알 수 있다(Kim과 Hwang, 2011).
복합 환경스트레스에 따른 CaPR10 유전자의 발현 양상을 분석하였다(Fig 4C, Fig 4 Supplementary Table 2). 토양 수분포텐셜 -30 kPa의 25°C, 30°C, 35°C 환경에서 CaPR10 유전자 발현량은 4.63×103 molecule·copy/mg, 9.90×103 molecule·copy/mg, 1.69×104 molecule·copy/mg 로 각각 확인되었다. 그리고, 토양수분포텐셜 -150 kPa에서 온도에 따른 유전자의 발현량은 1.47×104 molecule·copy/mg, 1.76×104 molecule·copy/mg, 4.43×104 molecule·copy/mg 로 각각 확인되었다(Fig 5C, Fig 5 Supplementary Table 2). 고추의 CaPR10 유전자 발현은 모든 온도조건에서 -30 kPa 보다 -150 kPa에서 최소 1.77배에서 3.18배 이상 높게 발현되는 것을 확인하였다. PR10 유전자는 유도성 방어 유전자로서 salicylic acid 와 ethylene과 같은 저분자 물질 또는 암(dark) 상태나 가뭄의 환경적 스트레스에 의해서 유도가 된다고 보고되었다(Durner 등, 1997; Ecker, 1995; Wang 등, 1999; Ziadi 등, 2001).
WRKY 단백질은 노화 및 병원성미생물로부터 방어기작에 관여하며, 생물학적 또는 비생물학적으로 조절되는 단백질로서 Arabidopsis에서 100여 개가 발견되는 superfamily에 속한다(Eulgem 등, 2000; Jang 등, 2018). 이에 본 연구에서 복합 환경스트레스에 따른 CaWRK1 유전자의 발현 양상을 분석하였다(Fig 5D, Fig 5 Supplementary Table 2). 토양 수분포텐셜 -30 kPa의 25°C, 30°C, 35°C 환경에서 CaWRK1 유전자 발현량은 2.55×103 molecule·copy/mg, 9.64×102 molecule·copy/mg, 3.52×102 molecule·copy/mg 로 각각 확인되었다. 그리고, 토양 수분 포텐셜 -150 kPa에서 온도에 따른 유전자의 발현량은 2.03×104 molecule·copy/mg, 1.56×104 molecule·copy/mg, 5.96×103 molecule·copy/mg 로 각각 확인되었다. 수분 스트레스 환경에서 CaWRK1 유전자 발현량은 25°C에서 7.95배, 30°C와 35°C에서 16.02배와 16.91배 높게 발현되는 것을 정량 분석을 통해 확인하였다. 수분스트레스 환경에서 방어기작 유전자인 CaWRK1 gene은 -30 kPa보다 -150 kPa에서 더 높게 발현되었으며, 이것은 세균점무늬병의 병원성균인 X. euvesicatoria이 강하게 작용하거나 비생물학적 요인에 의한 것이라 추론할 수 있다.
식물의 방어유전자는 성장과 대사과정에서 up-regulation 또는 down-regulation된다. CaWRKY1단백질이 과발현 된 담배 식물체가 담배 모자이크 바이러스에 감염되었을 때 대조군보다 더 광범위한 괴사 증상을 보인 결과가 보고되었다(Oh 등, 2008). 본 연구를 통해 X. euvesicatoria의 병원성 영향력은 토양 수분포텐셜 -30 kPa 환경보다 건조스트레스 환경인 토양 수분포텐셜 -150 kPa에서 더 큰 영향을 준다고 판단되며, 복합 스트레스 환경에서는 온도보다는 토양 수분포텐셜이 더 큰 영향력을 보이는 것을 확인하였다. 그러나, 병원성 미생물과 CO2 증가가 동시에 작용하는 복합스트레스 환경에 따른 식물의 상호 작용 연구에서 환경요인이 비생물학적 요인과 생물학적 요인 중 어느 쪽으로 더 유리하게 작용하는가에 따라 결과가 달라질 수 있다고 보고하고 있으며(Bettarini 등, 1998; Chakraborty 등, 2000; Hibberd 등, 1996), 본 연구결과에서는 수분 스트레스 환경에서 저항성 유전자가 강하게 증가하는 것을 확인하였는데 이는 생물학적 요소에 의해 증가되기도 하지만, 비생물학적 요인에 의해서도 증가할 수도 있다고 판단된다. 또한, 본 연구와 같은 복합스트레스 환경에서 CaLRR1, CaPIK1, CaPR10, CaWRK1와 같은 유전자 연구는 매우 부족한 상황으로 향후 더 많은 연구가 필요할 것으로 판단되며, 본 연구와 같이 저항성 유전자의 발현이 증가함에도 발병도가 증가하지만, 비생물학적 요인이나 생물학적 요인이 보다 강하게 작용하였을 가능성을 생각할 수 있을 것이다. 향후 보다 심도 깊은 연구가 진행될 필요성이 있으며, 본 연구는 이에 대응하기 위한 기초 자료로 활용이 가능할 것으로 사료된다.
요 약
본 연구는 온난화가 가속화된 환경에서 온도와 수분의 복합적인 스트레스에 의한 환경에서 고추세균점무늬병의 발병양상을 조사하였으며, 온도에 의한 발병률보다 토양의 수분함량에 의해 세균점무늬병 발병률이 증가하는 것을 확인하였다. 이는 온난화에 의한 1차적인 온도상승보다 2차적인 건조 스트레스에 따라 세균점무늬병의 발병률에 더 큰 영향을 주며, 온난화 가속에 따라 작물의 건조스트레스를 피하여 고추세균점무늬병의 피해를 줄일 수 있을 것으로 판단된다.
Electronic Supplementary Material
Supplementary materials are available at Research in Plant Disease website (http://www.online-rpd.org/).




 PDF Links
PDF Links PubReader
PubReader Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print