Lasiodiplodia pseudotheobromae에 의한 장미 가지썩음병의 발생 보고
First Report of Die-Back on Rose (Rosa hybrida) Caused by Lasiodiplodia pseudotheobromae in Korea
Article information
Abstract
In 2015, symptoms of die-back on Rosa hybrida were observed in Taean, Korea. The aims of this study were to determine the cause of die-back on Rosa hybrida and characterize the pathogen. The fungal isolates were obtained and used for pathogenicity test, morphological and molecular analyses. The pathogenicity test on healthy branches of Rosa hybrida produced die-back, as the original symptoms. For the morphological study, the isolates were inoculated onto potato dextrose agar and incubated for 7 days at 25°C. The colonies grew up quickly and turned white to gray in color. Conidia were observed under an optical microscope. The features of conidia were ellipsoidal, grayish brown in color, 20-31×11-17 µm in size and had one septum. Molecular analyses of the ITS region, TEF and TUB genes were conducted to confirm the identity of the pathogen. The phylogenetic tree of the multi-gene sequences indicated that the causal agent was Lasiodiplodia pseudotheobromae. This study is the first report of die-back caused by Lasiodiplodia pseudotheobromae on Rose (Rosa hybrida).
장미(Rosa hybrida)는 장미과의 다년생 식물로 세계적으로 인기 있는 작물 중 하나이다. 장미는 주로 정원의 관상식물과 긴 저장성을 가지고 있어 절화용으로도 많이 이용되며 향수 산업에서도 에센셜 오일의 재료로 사용되어 수요가 많다(Madhu와 Kanwar, 2015; Marchant 등, 1998). 이로 인해 새로운 품종의 요구도도 높아 장미에 대한 연구가 계속적으로 진행되고 있다 (Han 등, 2006). 장미에 발생하는 주요 병해로는 Botrytis cinerea에 의한 잿빛곰팡이병, Colletotrichum gloeosporioides에 의한 탄저병, Pestalotiopsis longisetula에 의한 점무늬병, Diplocarpon rosae에 의한 검은무늬병, Sphaerotheca pannosa에 의한 흰가루병, Coniothyrium fuckelii에 의한 가지마름병, Fusicoccum sp.에 의한 줄기마름병이 보고되어 있다(The Korean Society of Plant Pathology, 2009). 2015년 12월에 충청남도 태안군의 장미 재배하우스에서 품종 ‘오션송’의 가지가 갈변되어 썩고 검은포자체가 형성되어 있는 증상이 발견되었으며 재배하는데 큰 피해를 주고 있었다. 발병된 장미가지를 원인균을 찾기 위해 채집하였으며 병든 장미가지에서 자라난 균사체를 순수 분리하였다. 그 결과, 앞서 보고된 병원균과는 균총이 다르게 배양되었으며, 분리 균주가 병원성이 있음을 확인하였다. 이에 병원균을 동정하기 위하여 균학적 특성을 조사하고 곰팡이 동정용 프라이머를 이용한 유전자의 염기서열 분석을 통해 분자계통학적 유연관계를 분석하였다.
병징 및 병원균의 분리
2015년 12월에 충청남도 태안군의 장미 재배하우스에서 장미의 가지가 갈변되어 썩고 표면에 검은색 포자체가 붙어 있는 것을 발견하였다(Fig. 1A). 이와 같은 증상이 지속적으로 관찰되었으며 이 병의 원인을 찾고자 병원균을 분리하였다.

Symptoms of die-back on Rosa hybrida. (A) Typical symptoms in a greenhouse. (B) Symptoms of artificial inoculation using branches.
병원균을 분리하기 위해 병든 가지에서 병반을 잘라 1% 차아염소산나트륨용액으로 1분간 침지하여 소독을 하고, 멸균수로 씻어낸 후 물 한천배지(water agar, WA)와 감자한천배지(potato dextrose agar, PDA)에 치상하여 온도가 25°C로 설정된 인큐베이터에 배양을 하였다. 3일 후 치상한 병반에서 형성된 균사체를 새로운 PDA에 옮겨 순수배양 하였다. 이 분리 균주를 사용하여 병원성 검정을 실시하였다.
병원성 검정
분리 균주의 병원성을 검정하기 위하여 장미 품종 ‘오션송’의 건전한 가지를 1% 차아염소산나트륨용액으로 표면소독을 한 후 균총을 잘라 치상하였다. 처리 구는 3반복으로 실시하였고 무 처리구는 PDA를 사용하였다. 접종된 장미가지를 플라스틱박스에 습실 처리한 후 25°C 인큐베이터에 두어 경과를 지켜봤다. 3일 후 접종 부위가 갈변되었고, 7일 후에는 장미가지가 전체 고사하였다. 14일 후에는 고사된 장미 가지에 검은 포자체가 형성되었다. 처음 발견된 가지마름증상과 일치하였으며 접종 균주가 재분리 되어 병원성이 있음을 확인하였다(Fig. 1B).
병원균의 균학적 특성 및 유연관계 분석
병원균의 균학적 특성을 확인하기 위해서 분리 균주를 PDA에 25°C로 설정된 인큐베이터에 7일간 배양하였다. 분리 균주는 PDA상에서 균사 생육이 매우 빠르며 배양 3일차에 균총은 불투명한 백색을 띄다가 7일차에는 백색 균사가 잿빛으로 변하는 것을 확인하였다(Fig. 2A). 광학현미경으로 분생포자를 100개 관찰하였으며 분생포자의 형태는 회갈색의 타원형이며 끝이 둥글다. 분생포자 중간에 진한갈색의 격막이 하나 있다. 분생포자의 크기는 20-31×11-17 µm이다(Fig. 2B).
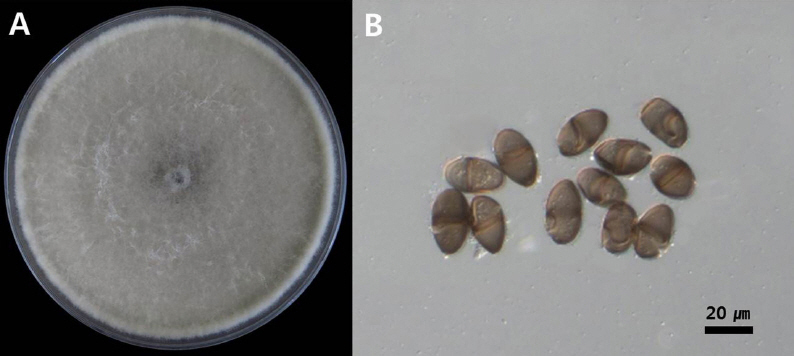
Morphological characteristics of isolates (A) Colony growth at 25°C on PDA after 5 days of incubation, (B) Spores (Scale bars: 20 mm).
균학적 특성을 기초로 하여 병원균의 동정을 수행하고자 염기서열 분석을 하였다. PDA에서 7일 간 배양한 분리 균주로부터 HiGene™ Genomic DNA Prep Kit (BIOFACT, Korea)를 이용하여 total genomic DNA를 추출하고 internal transcribed spacer (ITS) 영역과 translation elongation factor 1-alpha (TEF) 유전자와 beta-tubulin (TUB) 유전자를 증폭하기 위하여 각각 ITS1F/ITS4 (White 등, 1990), EF-688F/EF-1251R (Alves 등, 2008), bt2a/bt2b (Glass와 Donaldson, 1995) 프라이머 세트를 사용하였다. 증폭된 PCR 산물은 1% agarose gel에 전기 영동하여 확인하였고 ExoSAP-IT (Affymetrix, USA)를 이용하여 정제한 뒤 염기서열 분석을 의뢰하였다(BIOFACT). 각각의 염기 서열 분석결과는 미국생물공학정보센터(Natinoal Center for Biotechnology Information, NCBI, USA)에 저장되어 있는 염기서열들과 비교를 하였으며 Botryosphaeriaceae 과의 Lasiodiplodia pseudotheobromae로 동정되었다. 분리 균주의 ITS영역, TEF와 TUB유전자의 염기서열은 NCBI GenBank database에 각각 등록하였다(Accession numbers, ITS:LC270864-6; TEF:LC270867-9; TUB:LC314723-5).
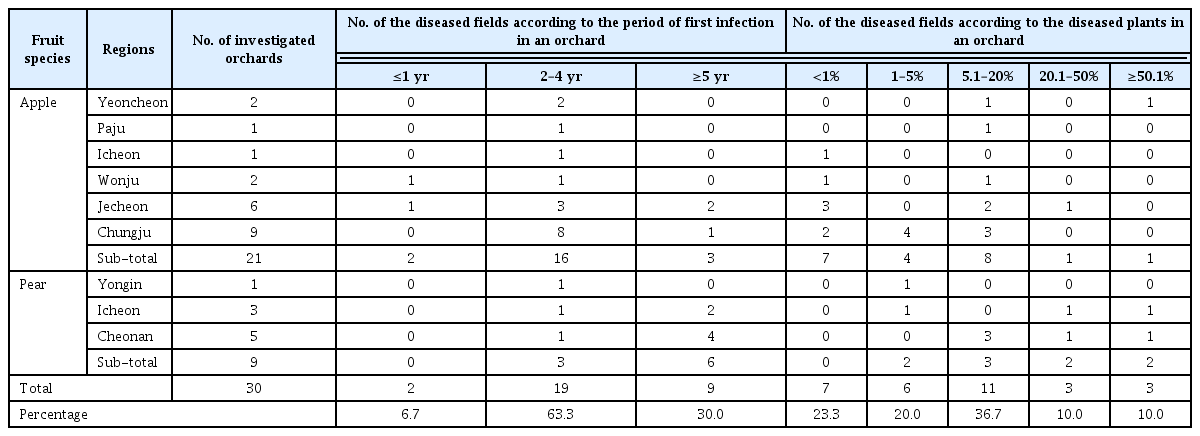
장미 가지썩음병균의 분자 계통학적 유연관계를 분석하기 위해 병원균의 염기서열과 Lasiodiplodia 속의 다른 종들과 근연종의 시퀀스를 NCBI의 Genbank database에서 수집한 후 ITS 영역, TEF 유전자, TUB 유전자의 염기서열들을 순서대로 결합하였다(Table 1). 계통수는 MEGA 6.0 프로그램에서 neighbor- joining method을 사용하여 작성하였다(Phillips 등, 2013; Tamura 등, 2013; Úrbez-Torres 2016). 장미 가지썩음병균의 분자 계통학적 유연관계를 분석한 결과 Lasiodiplodia pseudotheobromae로 동정하였다(Fig. 3). L. pseudotheobromae는 국내에서 망고 줄기마름병으로 보고된 바 있으며, 중국에서는 유럽종포도의 가지마름병, 호두나무의 줄기마름병이 보고되어 있다(Dissanayake 등, 2015; Kwon 등, 2017; Li 등, 2016). 이와 같이 장미에서 발생한 L. pseudotheobromae에 의한 병은 우리나라에 보고되지 않았으며 국내 최초로 장미 가지썩음병으로 명명하여 보고하고자 한다.
Sequences of L. pseudotheobromae and allied species included in this study for phylogenetic analyses
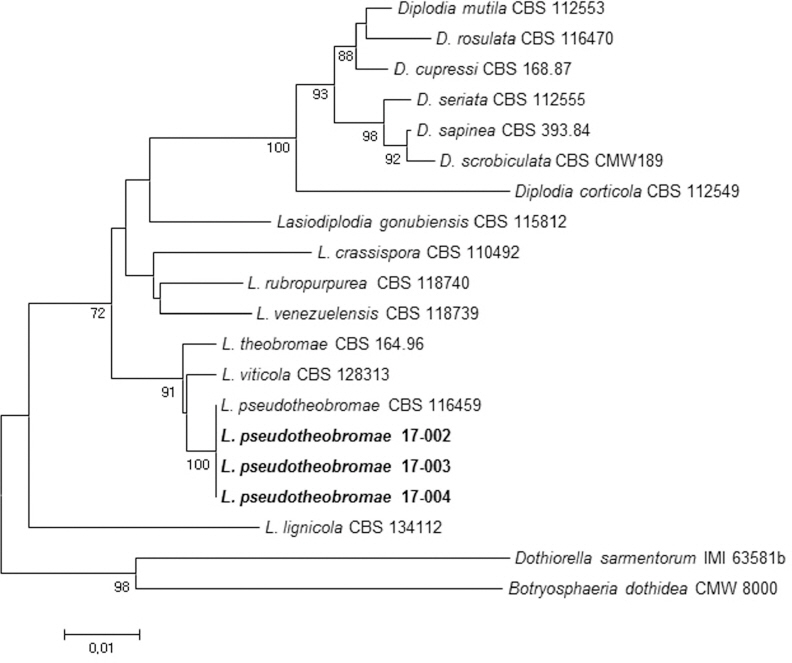
Phylogenetic relationship between Lasiodiplodia pseudotheobromae and other Lasiodiplodia species, constructed using the neighbor-joining tree analysis, based on the combined ITS region, TEF and TUB gene sequences. The numbers above the branches represent the bootstrap values obtained for 1,000 replicates (values smaller than 80 are not shown).
요약
2015년에 태안에서 장미의 가지 썩음 증상과 검은 포자체가 붙어 있는 새로운 증상이 관찰되었다. 이 증상의 원인을 찾기 위해 장미 가지의 썩음 증상에서 균사체를 분리하였다. 분리 균주의 병원성을 검정하였더니 건전한 장미 가지가 썩었으며 처음 발견했던 병징과 일치하였다. 형태학적 특성을 조사하고 분자생물학적 분석을 위하여 병원균을 25°C에 7일간 배양하였다. 병원균의 균사 생장은 빠르며 균총의 색깔은 흰색에서 잿빛으로 변했다. 광학현미경으로 관찰한 분생포자는 회갈색의 타원모양에 격막이 하나 있으며 크기는 20-31×11-17 µm이다. 병원균의 ITS 영역, TEF와 TUB 유전자의 염기서열을 결합하여 근연종과 유연관계를 분석한 결과 Lasiodiplodia pseudotheobromae로 동정되었다. 이에 따라 장미에서 L. pseudotheobromae이 발생시키는 가지 썩음 증상을 장미 가지썩음병으로 명명하여 보고하고자 한다.
Acknowledgement
This work was supported by the “Research Program for Agriculture Science and Technology Development” (Project title: Diagnosis of horticultural and herbal crops diseases and insect pests, Project No. PJ011368022017) Rural Development Administration, Republic of Korea.
Conflicts of Interest
The authors declare that they have no competing and commercial interests in this work.