오이 검은별무늬병 방제에 효과적인 유기농업자재 선발
Screening for Effective Organic Farming Materials for the Control of Cucumber Scab Caused by Cladosporium cucumerinum
Article information
Abstract
This study was conducted to evaluate the control efficacy of the organic farming materials on cucumber scab caused by Cladosporium cucumerinum PT1 (KACC 48094). The antifungal activities in vitro as well as the suppressive effect of 43 organic farming materials on the spore germination and germ tube growth by inoculating spore suspension on cucumber seedlings in vivo were investigated. Thirteen organic farming materials inhibited the mycelial growth of C. cucumerinum and nine of these were microbial agents. In the screening using cucumber seedlings, six organic farming materials were very effective with control efficacy value of 90%. Among them, Bacillus amyloliquefaciens M27 provided suppressive effect on both mycelial growth and spore germination against cucumber scab. Finally, nine organic farming materials were selected to test the protective and curative effects, and all chosen organic farming materials significantly suppressed disease incidence when applied in the preventive action, in comparison with the curative action. Especially, Bordeaux mixture I and III gave excellent protective control efficacy with control values of 96.7% and 73.3%, respectively, whereas its curative control effect was significant low. Among these, only Thymus quinquecostatus+Sophora extract showed curative activity, although the control value was as low as 50%. This study suggests that cucumber scab can be controlled by some organic farming materials in the farmhouses under comparatively cold and wet condition and protective treatment is more important and efficient.
서론
오이 검은별무늬병균(Cladosporium cucumerinum, cucumber scab)은 불완전 균류에 속하고 20°C–25°C에서 생장이 가장 우수한 병원균으로, 오이 반촉성 및 조숙재배와 같이 시설 내 온화한 조건에서 발병이 용이하다. 2016년에도 전북 완주군 국립농업과학원 내 유기농 오이 연작 시설재배지에서 이 병에 대한 피해가 나타나는 등 보고가 증가하고 있는 추세이며, 이에 따라 병원균의 특성연구 및 저항성 품종 선발을 위한 연구가 이루어지고 있다(Lee 등, 1997; Park 등, 2015). 주로 어린 과실이나 연한 잎, 생장점에 발생하며 병든 잎이나 줄기에서 균사나 분생포자 형태로 월동하여 1차 전염원이 되고, 2차 전염원은 병반상에 형성된 분생포자가 바람에 비산되어 이루어지기 때문에 발병을 조기에 발견하여 약제를 살포해야 한다고 하였다(Kim, 1999). 방제약제로는 dithiocarbamate 분무처리가 성공적이라고 보고되었고(Ellis와 Holliday, 1972), 우리나라에는 디페노코나졸 등 24품목의 작물보호제가 등록되어 있는 등 화학적 방제가 주로 이루어지고 있다(KCPA, 2016).
Jeong 등(2016)에 따르면 친환경농산물 재배면적은 2013년 이후 감소해왔으나 2016년 이후 정부의 제4차 친환경농업 육성 5개년 계획의 추진으로 증가세로 전환될 것이라고 전망했고, 따라서 유기농업에 대한 관심과 중요성도 증가할 것이라 예상된다. 하지만 유기농업은 관행농업에 비하여 병해충 방제와 제초작업에 많은 노동력이 투입되고 값비싼 유기농자재를 구입하여 사용하기 때문에 생산비가 높게 나타나 어려움을 겪고 있음이 보고되었다(Sung과 Jung, 2015). 여러 유기농업자재가 개발되어 2016년에는 1,459개의 품목이 고시되어 있고, 이 중 병해관리용 제제는 166품목으로 광물질, 미생물 그리고 식물추출물 등을 유효성분으로 하는 제품이 포함되어 있으며, 기 개발된 유기농업자재를 이용하여 고추 역병과 탄저병(Park 등, 2012), 잿빛곰팡이병(Hong 등, 2015; Kwak 등, 2012b), 그리고 유자에 발생하는 주요 병해(Park 등, 2014)에 대한 방제 연구가 보고된 바 있다. 하지만 오이 검은별무늬병에 대하여서는 Bacillus subtilis KMU-13이 높은 항진균 활성을 나타냈다는 보고(Park 등, 2006) 외에 유기농업자재의 방제효과가 규명되어 있는 정보가 미미하기 때문에 유기농업을 하는 농민들이 유기농업자재를 적시적지에 효과적으로 사용하지 못하고 있는 것이 현실이다. 따라서 본 연구는 오이 검은별무늬병에 대해 효과적인 유기농업자재 선택 및 이를 활용한 효과적인 사용법을 확립하기 위하여 수행하였다.
재료 및 방법
병원균 및 유기농업자재
오이 검은별무늬병균인 C. cucumerinum PT1 (KACC 48094)은 2015년 경기도 평택의 오이 하우스 재배지의 오이 이병과실에서 순수 분리한 것을 potato dextrose agar (PDA) 배지에 접종하여 20°C에서 배양하면서 본 실험에 사용하였다. 오이 검은별무늬병에 효과적인 유기농업자재를 선발하기 위해 공시한 유기농업자재는 농촌진흥청 유기농업자재 정보시스템에 등록된 제품 중에서 규산나트륨 등 광물질유래 15품목, Bacillus amyloliquefaciens M27 등 미생물 제제 12품목, 정향오일 등 식물추출물 제제 13품목, 키토산 등 기타 3품목의 총 43제품을 라벨에 있는 권장사용량에 따라 희석하여 실험에 사용하였다(Table 1).
항균활성 검정
43품목의 유기농업자재 중에서 균사생장을 억제하는 자재를 선발하기 위해 paper disc 검정방법으로 실험하였다. 시험균주인 C. cucumerinum PT1의 균사 끝부분을 5 mm cork borer로 잘라 병원균 agar disc 조각을 PDA (Difco, Detroit, MI, USA) 배지 중앙에 이식하였다. 8 mm paper disc를 중앙으로부터 약 2.5 cm 떨어진 곳에 치상하였고, 유기농업자재는 멸균수를 이용하여 품목별 추천농도로 희석한 것을 4반복으로 하여 30 μl씩 점적 처리한 뒤 20°C 항온기에서 암조건으로 배양하였다. 12일 후 생장저지원(inhibition zone)의 직경을 측정함으로써 항균활성 여부 및 정도를 조사하였다.
오이 유묘를 이용한 오이 검은별무늬병에 효과적인 유기농업자재 선발
43품목의 유기농업자재 중에서 오이 검은별무늬병의 포자발아억제 및 균사생장을 억제하는 자재를 선발하기 위해 2–3엽기 전개된 ‘은미엠’ 오이 품종의 유묘를 사용하였다. 오이 검은별무늬병원균의 포자현탁액을 제조하기 위하여 오이 C. cucumerinum PT1의 균사 끝부분을 5 mm cork borer로 잘라 PDA 배지 중앙에 접종 후 20°C 암상태에서 14일간 배양하였다. 배양된 병원균에 멸균수를 부어 루프로 포자를 떼어낸 후 4겹 거즈로 걸러서 포자만 수확하여 1×105 포자/ml로 조절하였다. 오이 유묘에 3반복으로 분무접종하고 1시간 동안 건조한 뒤 조제한 유기농업자재를 분무처리 하였다. 처리된 식물체는 온실 내에서 16.5°C–18.5°C, 상대습도 70%–90%, 오전 9시부터 오후 6시까지 9시간 동안은 광조건으로, 오후 6시부터 다음날 오전 9시까지 15시간 동안은 암조건으로 하였으며, 10일 후 병 발생 정도를 조사하여 방제가를 산출하였다. 병 발생 정도는 발병 수준을 0–5로 나누어 0은 무발병, 1은 생장점 갈변, 2는 생장점 고사, 3은 생장점 고사와 본엽에 갈색 병반, 4는 생장점 및 본엽 일부 고사, 5는 식물체 완전 고사로 하였다.
오이 유묘를 이용한 오이 검은별무늬병에 대한 예방 및 처리효과 검정
유묘검정을 통하여 오이 검은별무늬병에 85% 이상의 방제효과를 나타낸 광물질 유래 3품목, 미생물 제제 4품목, 식물추출물 제제 2품목 등 9개의 유기농업자재를 선발하여 예방 및 치료 효과를 검정하였다. 효과가 우수한 유기농업자재를 선발했기 때문에 예방 및 처리효과 실험에서는 병원균 포자의 발아율과 발아포자의 부착기 형성을 빠르게 하여 초기발병이 유리하게 하기 위해 온도조건은 23.7°C–25°C, 상대습도는 80%–90%로 하였고, 예방효과는 병원균을 분무 접종하기 1일 전에, 치료효과는 병원균을 분무 접종하고 1일 후에 유기농업자재를 처리하였다. 공시 오이품종, 오이 검은별무늬병원균 포자현탁액의 농도와 광조건 및 발병정도 측정은 위의 유기농업자재 선발 검정과 동일하였으며, 2주 후 병 발생정도를 조사하여 방제가를 산출하였다.
통계분석
데이터 수집 후 처리구 평균 간 유의성 검정을 위하여 SAS 프로그램(ver. 9.1; SAS Institute, Cary, NC, USA)을 이용하여 Duncan’s multiple range test를 실시하였다.
결과 및 고찰
오이 검은별무늬병에 대한 항균활성 검정
유기농업자재 43개 중 오이 검은별무늬병원균의 균사생장 억제 효과를 나타낸 것은 총 13개였고, 처리 간에 유의한 차이가 있었으며(F=3.48, P=0.0017), 억제하는 형태도 유기농업자재별로 다양했다. 이 중 미생물 제제가 9품목으로 대부분을 차지했을 뿐만 아니라 균사생장 억제효과도 뛰어났다(Table 2, Fig. 1). 특히 B. subtilis DBB1501 수화제가 오이 검은별무늬병에 대하여 억제효과가 가장 높았고, Bacillus velezensis NSB-1 액상수화제도 우수하였다. 이는 Bacillus 균주가 여러 식물병원균에 항균활성이 있다는 보고와 일치된다(Cochrane과 Vederas, 2016; Nielsen과 Sørensen, 1997; Zhang 등, 2008). Hong 등(2015)은 시험에 사용된 대부분의 유기농업자재들에서 잿빛곰팡이병 병원균의 균사 생육억제 효과가 나타났다고 하였지만, Kwak 등(2012a, 2012b)은 유기농업자재 중 B. subtilis를 주성분으로 하는 미생물자제가 잿빛곰팡이병과 탄저병 균사생장억제효과가 높았으며 식물추출물이나 광물질이 주성분인 자재의 경우는 낮은 균사생장억제효과를 나타낸다고 하였는데, 본 실험에서도 광물질유래 및 식물추출물유래의 유기농업자재는 균사생장억제효과가 낮거나 없었다.

Inhibition effect of organic farming materials on mycelial growth of Cladosporium cucumerinum causing cucumber scab
오이 검은별무늬병 포자현탁액 분무접종을 통한 유묘검정
유기농업자재를 처리하기 1시간 전에 오이 유묘에 오이 검은별무늬병 포자 현탁액을 접종한 뒤 유기농업자재를 권장 사용량대로 희석하여 처리한 실험에서 전체 43개 유기농업자재 중 90% 이상의 우수한 방제효과를 나타낸 유기농업자재는 B. amyloliquefaciens M27, 미생물 대사산물 추출물 I, 백리향+고삼 추출물, 초미립자 유황 제제, 보르도액 I과 보르도액 III, 총 6품목이었다(Fig. 2).
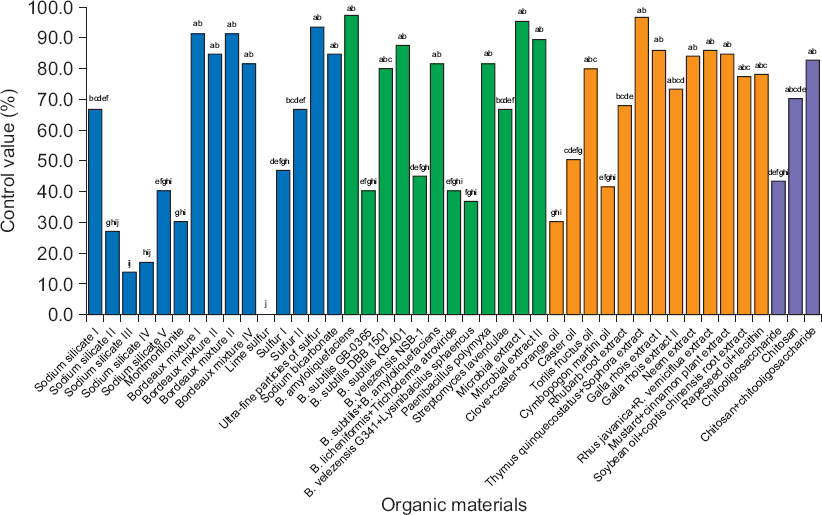
Suppressive effect of 43 organic farming materials against cucumber scab on the ‘Eunmi M’ seedlings. After inoculation of Cladosporium cucumerinum spore suspension containing 1×105 spores/ml, all organic material treatments were applied the same day about an hour later. The different letters indicate significantly different (P<0.01) according to Duncan’s multiple range test.
미생물 제제인 B. amyloliquefaciens M27이 97.3%로 포자발아 및 발아관 신장 억제효과가 가장 우수하였으며, 미생물의 대사산물 추출물 I이 95.3%로 나타났다. Bacillus 균주는 대체로 식물 병원균을 억제하는 항생물질을 포함하여 많은 생활성 화합물을 생산한다고 보고되었는데(Emmert와 Handelsman, 1999; Katz와 Demain, 1977), 특히 본 유묘실험을 통해 억제효과가 뛰어났던 B. amyloliquefaciens M27 균주는 항균활성 검정을 통해 넓은 스펙트럼의 병원균의 생장을 억제했음을 제시했고(Kim 등, 2008), 또한 B. amyloliquefaciens로부터 생합성 항균물질과 관련된 bacillomycin, fengycin, iturin, surfactin 등과 식물 생육 촉진물질과 관련된 bacillibactin의 유전자가 발견되었다고 보고하였다(Arguelles-Arias 등, 2009; Borriss 등, 2011; Lee 등, 2012). 식물추출물 제제인 백리향+고삼 추출물이 혼용된 자재는 96.7%의 방제효과를 나타냈다. 백리향(Thymus quinquecostatus)은 thymol 성분을 함유하고 있는 Thymus속 식물로(Choi 등, 2013), thyme 오일이나 그 주성분인 thymol이 몇몇 식물병원균에 대해 살균활성, 포자발아억제 효과가 있으며 오이작물에서 잿빛곰팡이병균(Botrytis cinerea)에 대한 예방효과가 있다고 보고되었고(Choi 등, 2006), matrine이 유효성분인 고삼(Sophora flavescens) 추출물은 고농도에서 약간의 항균활성을 나타냈다(Hwang 등, 2014)고 하였다. 또한 식물추출물 오일은 기주식물 저항성 반응을 증가시킬 수 있다고 하였는데(Northover와 Timmer, 2002), 본 실험에서 오이유묘를 이용해 포자발아억제 정도를 검정할 때에는 방제효과가 우수하게 나타났으나 항균활성 검정에서는 균사생장 억제효과를 나타내지 않았다. 이는 식물추출물질이 식물의 생리활성을 촉진시키며 저항성 향상에 도움을 주었거나 포자 발아에만 특이적으로 억제하는 물질이 작용했을 것이라고 생각한다.
무기화합물 제제인 초미립자 유황이 함유된 자재는 93.3%, 보르도액 I과 III이 91.3%의 방제가를 나타냈다. 유황 원소는 진균세포를 투과할 수 있고(Beffa, 1993) 세포질로 흡수되어 미토콘드리아 호흡에 영향을 주며, 산소 대신 수소이온이 황으로 전달될 수 있어 유독한 황화수소 생성의 원인이 되는데 이 물질이 세포단백질에 독소로 작용하여 진균 세포를 죽이는 데 관여한다고 하였다(McCallan과 Wilcoxon, 1931; Miller 등, 1953). 또한 Tweedy와 Turner (1966)는 시토크롬 b와 c 단계에서 미토콘드리아 전자전달의 방해가 균류에 독성을 나타냈을 것이라 암시했다. 더욱이 유황을 식물에 적용할 때 작은 입자가 큰 입자보다 더 넓은 범위를 제공하고 부착력도 더 우수하기 때문에 잎과 병원균 조직에 작은 입자가 더욱 효과적이다(Wilcoxon과 McCallan, 1931)라고 하였는데, 본 실험에서도 석회유황합제보다 초미립자유황 제제의 방제효과가 뛰어난 이유도 입자의 크기가 영향을 미쳤을 것이라 생각된다. 구리 제제는 불용성 화합물이지만 물과 접촉했을 때 구리이온 유출로 인하여 살균제로서 작용을 하며, 병원균의 포자가 발아하면서 구리이온이 병원균 내로 흡수되어 단백질에 존재하는 다양한 화학작용기인 imidazoles, phosphates, sulfhydryls, hydroxyls과 결합하고 그들의 기능을 방해하기 때문에 세포단백질의 비특이적 변성을 일으킨다고 하였다(Caldwell 등, 2013). 본 실험에 처리한 구리 제제인 보르도액은 항균활성 검정에서 균사생장을 전혀 억제하지 못했으나 포자발아 및 발아관 신장 억제효과가 나타났는데, 이는 Everett와 Timudo-Torrevilla (2007)의 주요 식물병원균에 대한 연구와 유사한 결과였다. 이렇게 미생물의 2차 대사물질, 식물추출물질의 유효성분, 그리고 미네랄 성분들이 오이 검은별무늬병균의 포자발아와 발아관 신장을 억제했을 것으로 생각된다.
하지만 유기농업자재의 주성분이 같더라도 함량, 제형 및 희석배수에 따라 방제효과에 있어서 차이가 있었다. 구리 제제는 모두 80% 이상의 높은 방제효과를 나타냈으나 규산나트륨 제제는 13.3%–66.7%로 저조하였으며, 유황 제제는 0%–93.3%의 다양한 범위의 방제가를 나타냈다. 미생물 제제와 식물추출물 제제 또한 유래미생물 및 식물체의 종류, 혼용조합 등에 따라 각각 36.7%–97.3%, 30%–96.7%로 다양하게 나타났는데, Kim 등(2011)은 미생물제의 유효미생물은 저장온도 및 기간과 제형에 따라서 미생물 활성에 영향을 미칠 수도 있다고 하였다. 본 실험에서도 액상수화제보다 수화제와 유상현탁제에서 항균활성이 우수하게 나타났고 발병 억제 효과가 높았다. 석회유황합제를 처리한 오이 유묘에서는 식물체가 완전히 고사하였는데, 제품의 유효성분이 오이 검은별무늬병의 포자발아 및 균사생장을 억제하지 못한 것인지 또는 고농도로 인한 약해 때문인지 규명할 수가 없어 농도를 달리하여 추가실험이 필요하겠다. 따라서 오이 검은별무늬병을 방제하고자 유기농업자재를 선택할 때 신중한 주의가 필요할 것이다.
오이 검은별무늬병균은 어린잎을 침해하는 데 분생포자가 발아하여 발아관 끝이 표피세포의 봉합부에 이르게 되면 부착기를 형성하여 거기에서 균사가 세포간극으로 뚫고 들어가는 세포 봉합부 침입을 한다고 하였다(Pierson과 Walker, 1954). 따라서 유기농업자재를 처리하여 방제하고자 할 때에는 분생포자의 발아 및 균사생장을 억제하여 식물체에 침입할 수 없도록 하는 것에 착안점을 두어야 하는데, in vitro 항균활성 검정과 in vivo 유묘검정 결과, 포자 발아 및 균사생장, 이 두 가지 모두를 억제하는 유기농업자재는 B. amyloliquefaciens M27로 나타났다. 이 균주는 오이 흰가루병에 대해서도 방제효과가 있는 것으로 보고된 바 있어(Lee 등, 2013a, 2013b) 한 가지 제품의 유기농업자재를 처리함으로써 오이에 발생하는 여러 병을 방제할 수 있다면 효율적인 병해 관리가 될 수 있을 것이라 생각된다.
오이 유묘를 이용한 오이 검은별무늬병에 대한 유기농업자재의 예방 및 치료효과 검정
43개 유기농업자재 중 유묘검정을 통해 85% 이상의 방제효과를 나타낸 9개 자재를 선발하여, 오이 검은별무늬병 포자현탁액 분무 접종 24시간 전에 오이 유묘에 유기농업자재를 처리한 예방적 방제와 24시간 후에 처리한 치료적 방제 효과를 비교하였다(Fig. 3, 4). 병원균 침입 전에 처리한 예방적 처리구가 병원균이 침입한 후에 처리한 치료적 처리구보다 대체적으로 발병 억제 효과가 우수하게 나타났다. 특히 보르도액 I과 III의 예방적 효과는 각각 96.7%, 73.3%로 탁월하였으나 치료적 효과는 0%, 16.7%로 현저하게 낮게 나타났다. 백리향+고삼 추출물이 함유된 자재에서만 유일하게 예방적 처리보다 치료적 처리의 효과가 높게 평가되었으며, 치료적 처리의 방제가도 50%로 다른 자재들보다 높게 나타났다. 따라서 시설하우스 내 오이 연작 재배지 또는 오이 검은별무늬병 피해 상습지역에서는 병 발생이 예상되는 시기에 보르도액을 미리 살포하여 포자 발아를 억제하도록 하고, 이에 더하여 식물체가 생장함에 따라 잎과 줄기 등에 보르도액의 피복률을 유지함으로써 오이 검은별무늬병원균이 식물체에 침입할 수 없도록 주기적으로 처리를 해야 효과적인 병 방제가 될 것이다. Park 등(2016)은 오이 노균병 방제를 위해 유기농업자재를 처리한 결과 석회보르도액 4–6식이 높은 방제효과를 보였다고 하였으므로, 석회보르도액 처리는 오이 검은별무늬병 뿐만 아니라 오이 재배시 주요한 병해인 노균병 방제에도 효과적일 것이라 생각된다.
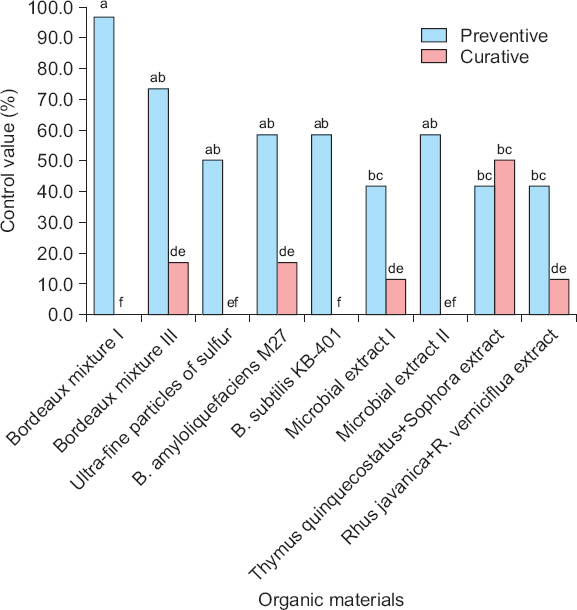
Preventive and curative activity of 9 selected organic farming materials against Cladosporium cucumerinum. For preventive treatments, cucumber seedlings of the ‘Eunmi M’ were sprayed with organic farming materials and then C. cucumerinum spore suspension containing 1×105 spores/ml of inoculum was applied 24 h later. For curative treatment, organic farming materials were applied, after inoculation of C. cucumerinum, as spray on cucumber seedlings 24 h earlier. The different letters indicate significantly different (P<0.01) according to Duncan’s multiple range test.

Symptoms of cucumber scab on cucumber seedlings when Bordeaux mixture I (A) and Bacillus amyloliquefaciens M27 (B) were treated one day before (left) and after (right) inoculation of cucumber scab pathogen.
오이 검은별무늬병은 주로 어린 과실이나 연한 잎, 생장점에 발생하기 때문에 자재를 살포할 때에는 생장점 부근이 골고루 묻도록 정성 들여 살포해야 하는데, 보르도액만을 처리할 경우 식물체에 대한 약해 등이 문제가 될 수 있다(Fernandes와 Henriques, 1991; Martins 등, 2012). 따라서 유묘검정을 통해 오이 검은별무늬병에 효과가 있었던 백리향+고삼추출물과 B. amyloliquefaciens M27 등의 다른 친환경 자재도 활용하여 석회 보르도액과 교호살포하는 방제체계 구축 및 포장에서의 효과검정에 대한 추가적인 연구가 필요할 것으로 판단된다.
요약
본 연구는 Cladosporium cucumerinum PT1 (KACC 48094)에 의해 발생하는 오이 검은별무늬병에 대하여 유기농업자재의 방제효과를 평가하기 위해 수행되었다. 43품목의 유기농업자재를 대상으로 실내에서 항균활성 검정과 온실에서 오이 유묘에 포자현탁액 접종을 통한 유묘검정을 실시하였다. 13개 품목의 유기농업자재가 균사생장을 억제하였고, 이 중 9개 품목이 미생물 제제였다. 오이 유묘를 이용한 검정에서 6품목의 유기농업자재가 90% 이상의 우수한 방제효과를 나타냈다. 그 중에서 Bacillus amyloliquefaciens M27이 유효성분인 미생물 제제의 억제효과가 가장 뛰어났다. 그 다음으로 9개의 유기농업자재를 선발하여 예방적 및 치료적 효과를 알아보기 위해 적용하였는데, 예방적으로 처리했을 때 9개 자재 모두 병 발생을 상당히 억제하였다. 특히, 보르도액 I과 III은 방제가가 각각 96.7%, 73.3%로 훌륭한 예방효과를 나타냈다. 이 중 백리향+고삼 추출물이 함유된 자재에서만 방제가가 50%로 다소 낮았지만 치료적 처리의 효과가 나타났다. 이 연구를 통해 시설 내 온화하고 습한 조건에서 잘 발생하는 오이 검은별무늬병은 유기농업자재로 방제될 수 있고 예방적 처리가 더욱 중요하고 효과적임이 확인되었다.
Acknowledgement
This study was carried out with the support of Research Program for Agricultural Science & Technology Development (Project No. PJ01087903), National Institute of Agricultural Sciences, Rural Development Administration, Republic of Korea.
References
Notes
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.