Botryosphaeria dothidea에 의한 오미자 줄기마름병
Twig Blight on Chinese Magnolia Vain Caused by Botryosphaeria dothidea in Korea
Article information
Abstract
2015년 6월에 경북 문경시에서 재배하는 오미자에서 줄기마름증상이 발생하였다. 발병 초기에는 잎의 선단 부위부터 위축되면서 고사현상이 발생하였고, 병이 진행됨에 따라 줄기를 거쳐 식물체 전체가 고사하였으며 주변으로 전염되었다. 감염된 줄기에서 병원균을 분리배양하여 배양적, 형태적 특징을 관찰한 결과 해당 병원균은 Botryosphaeria속에 속하는 것으로 나타났으며, 인공접종에 의한 병원성 검정에서도 동일한 병징을 나타내었다. 병원균의 정확한 동정을 위해 ITS 영역과 β-tubulin, EF1-α 유전자의 염기서열을 복합적으로 사용한 염기서열 분석을 수행하였으며, 분석 결과 오미자의 줄기마름 증상을 일으키는 원인균은 B. dothidea로 동정되었다. 지금까지 국내에서 B. dothidea에 의한 오미자의 병이 보고되지 않았기에 본 연구를 통해 국내 처음으로 B. dothidea에 의한 오미자 줄기마름병을 보고한다.
Trans Abstract
The twig blight symptoms were observed in Chinese magnolia vine (Schisandra chinensis) at Mungyeong city, Gyeongbuk province, Korea in June 2015. The typical symptoms of infected plant were shriveled and wilted in leaves which led to blight resulted in death. Based on the morphological characteristics, the isolate was suspected as Botryosphaeria sp. Inoculation of isolated pathogen was performed to identify its pathogenicity according to Koch’s postulates. Re-isolated fungi from the inoculated stem was showed same morphological characteristics with original pathogen. Phylogenetic analysis was performed using combined sequence of rDNA internal transcribed spacer region, EF1-α and β-tubulin gene. The isolated pathogen was identified to the B. dothidea by phylogenetic analysis. This is the first report of twig blight on S. chinensis caused by B. dothidea in Korea.
본문
오미자(Schisandra chinensis Baill.)는 오미자과에 속하는 다년생 덩굴식물로, 동아시아 지역에서 오랜 기간 동안 간질환 및 심혈관 질환의 치료제로 쓰이거나 강장제로 활용되어왔다(Samrat 등, 2015). 현대에 들어서 오미자의 항산화 및 항균효과에 대한 보고가 이루어지면서 약재뿐만 아니라 다양한 건강식품 및 미용제품으로서 활용되고 있다(Nam 등, 2014). 이에 따라 우리나라에서도 재배면적이 해마다 늘고 있는 추세이며, 2013년 기준 2,155 ha의 재배면적으로부터 9,575톤의 오미자가 생산되고 있고 지속적으로 생산량이 증가할 것으로 예상된다(Ministry of Agriculture, Food and Rural Affairs, 2014).
2015년 6월, 경상북도 문경시의 오미자 재배지역에서 줄기마름 증상이 발생하였다. 줄기마름 증상이 관찰된 식물은 잎이 위축되면서 선단 부위부터 고사하기 시작하였고, 증상이 진행됨에 따라 줄기로부터 식물 전체로 퍼져나가 식물체가 고사하였다. 병반이 나타난 줄기는 짙은 갈색 또는 검은색으로 변색되었고 검게 변색된 줄기의 표면으로부터 병자각이 형성되었다. 또한, 증상이 발생한 오미자로부터 주변으로 전염이 진행되는 것이 관찰되었다(Fig. 1).

Symptoms of twig blight on Chinese magnolia vine caused by Botryosphaeria dothidea. (A) Infected plants (symptoms in circles). (B) Pycnidia on stem. (C) Conidia from pycnidia.
줄기마름 증상을 일으키는 병원균을 동정하기 위해 병이 발생한 줄기로부터 병원균을 분리배양하였다. 분리된 병원균은 감자한천배지(potato dextrose agar medium, PDA)상에서 구름모양의 흰색균사를 형성하였으며, 배양 후 약 3–4일 뒤부터 plate 뒷면의 중심부가 검은색으로 변색되기 시작하였다. 또한 동시에 작고 검은 점들이 나타나기 시작하였다. 배양 7일 후 PDA plate 전체로 균사가 생장하였으며, 이후 약 14일만에 뒷면이 모두 검은색으로 변하였다(Fig. 2A, Fig. 2B). 분생포자를 관찰하기 위해 14일간 배양한 PDA의 기중균사를 모두 제거하고, 가시광선을 조사하였다. 가시광선의 조사는 기중균사를 제거한 PDA를 12시간 동안 가시광선에 노출시키고 다시 12시간 동안 암조건에서 배양하는 것을 반복하는 방식으로 수행하였다. 3주 동안 가시광선의 조사를 진행한 결과 배지의 표면에 검은색 분생포자 덩어리가 나타났으며, 분생포자 덩어리를 희석하여 광학현미경으로 분생포자를 관찰하였다. 분생포자는 격벽이 없는 무색의 타원형으로 크기는 17.7–25.6×6.8–8.2 μm였으며, PDA상에서 균핵이나 강모는 관찰할 수 없었다(Fig. 2C).
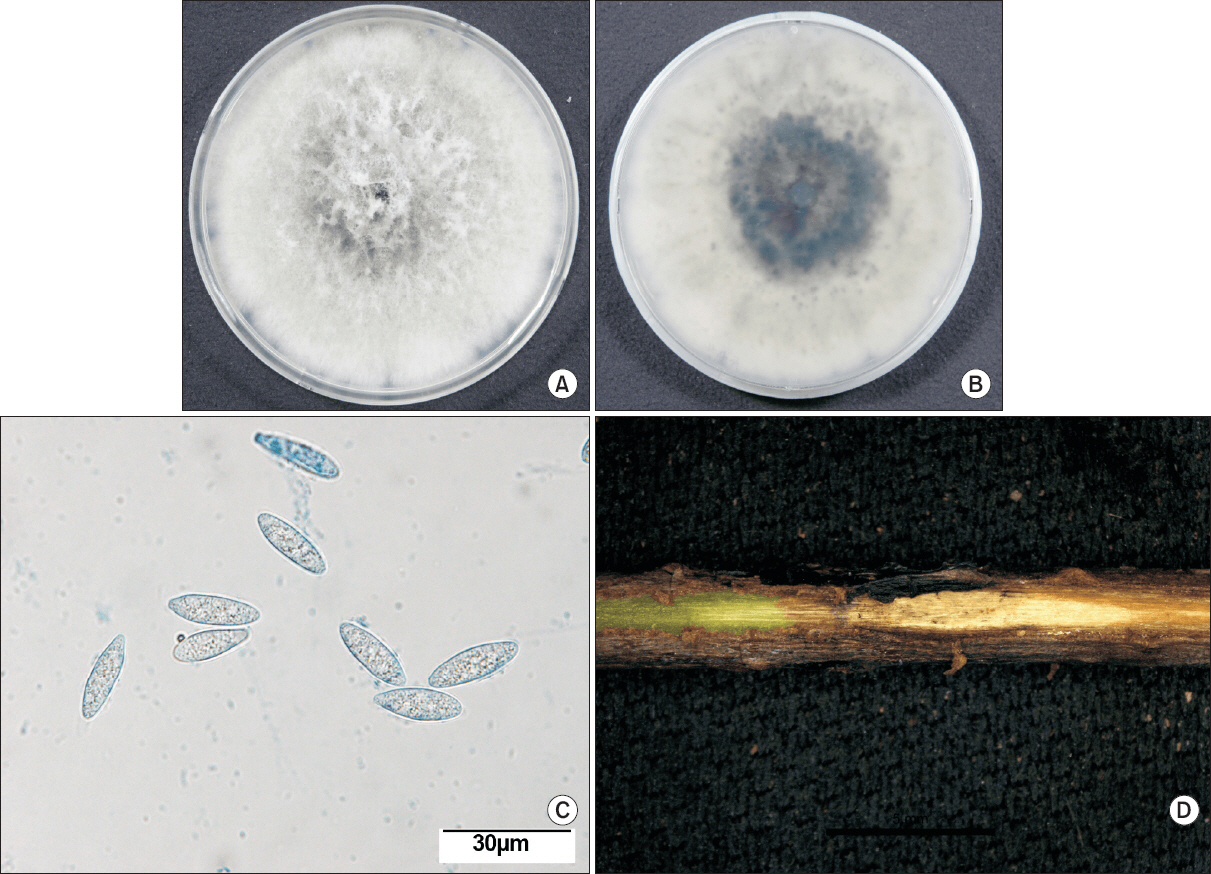
Morphological and cultural characteristics of Botryosphaeria dothidea. The front (A) and back (B) side of colony on potato dextrose agar plate. (C) Conidia (×400). (D) Symptoms on the stem of Chinese magnolia vine by artificial inoculation.
분리배양한 병원균의 병원성을 검증하기 위해 병원균을 배양한 PDA를 5 mm 지름의 원형으로 잘라내어 균총디스크를 제작하였다. 건전한 오미자 식물체의 줄기를 70% 알코올로 닦아 표면을 소독하고, 멸균한 바늘로 상처를 낸 부위와 상처를 내지 않은 부위에 각각 균총디스크를 접지한 뒤 수분증발을 막기 위해 랩으로 밀봉하였다. 24시간 동안 접지한 뒤 균총디스크를 제거하고 온실에서 배양하여 접종 부위에서 이상 증상이 나타나는지 관찰하였다. 접종 10일 후 상처를 낸 줄기로부터 최초 병원균을 분리한 줄기에서 나타난 병징과 동일한 병징을 관찰할 수 있었으며, 나타난 병반으로부터 다시 병원균을 분리배양한 결과 동일한 배양적, 형태적 특징을 가지는 균이 분리되었다(Fig. 2D). 병원균의 배양적, 형태적 특징을 통해 해당 병원균은 Botryosphaeria sp.로 판명되었으며, Slippers 등(2005)이 보고한 균학적 특징과 일치하였다(Table 1).
Morphological characteristics of the present isolate obtained from Schisandra chinensis Baill. and Botryosphaeria dothidea described previously
분리한 병원균의 정확한 동정을 위해 염기서열 분석을 실시하였다. PDA에서 1주일간 배양한 병원균으로부터 genomic DNA를 추출하고 곰팡이의 동정에 널리 쓰이는 유전자의 염기서열을 분석하기 위해 polymerase chain reaction (PCR)을 수행하였다. 분석의 정확성을 높이기 위해 일반적으로 사용되는 internal transcribed spacer (ITS) 영역과 Botryosphaeria속의 동정에 사용되는 β-tubulin, translation elongation factor 1-α (EF1-α)의 유전자를 함께 사용하였으며, 각각 ITS1F/ITS4 (White 등, 1990), Bt2a/Bt2b (Glass와 Donaldson, 1995), EF1-728F/EF1-986R (Carbone 등, 1999) primer set을 PCR에 사용하였다. 증폭한 PCR 산물을 1.5% agarose gel에 전기영동하여 확인하였고 ExoSAP-IT를 이용하여 정제한 뒤 염기서열을 분석하였다. 분석한 염기서열은 BLAST search를 통해 National Center for Biotechnology Information (NCBI)의 GenBank database에 저장되어 있는 염기서열들과 비교하여 병원균의 종을 확인하였다. 분석 결과, 분리한 병원균의 ITS 영역, β-tubulin 및 EF1-α 유전자의 염기서열을 모두 NCBI GenBank database에 각각 등록하였으며(accession No. LC120711, LC120690, LC120691), 분석한 유전자의 염기서열들은 모두 Botryosphaeria dothidea로 등록되어 있는 균주들의 염기서열과 >99% 일치하는 것으로 확인되었다.
계통수의 분석은 Botryosphaeria속에 속하는 여러 종의 ITS 영역, β-tubulin, EF1-α 유전자의 염기서열들을 NCBI의 Genbank database로부터 조사하여 수행하였다. NCBI의 데이터베이스 및 본 실험의 염기서열 분석으로부터 얻은 ITS 영역, β-tubulin, EF1-α 유전자의 염기서열들을 순서대로 연결하여 결합염기서열을 작성하고 이를 계통수의 작성에 사용하였다(Table 2). DNA Data Bank of Japan (DDBJ) 홈페이지 (http://www.ddbj.nig.ac.jp)의 염기서열 분석기능을 사용하여 결합염기서열들을 정렬하고 TreeView 프로그램(Page, 1996)을 사용하여 neighbor-joining 방법으로 계통수를 작성하였다. 분석 결과, 오미자 줄기마름병의 병원균은 명확하게 B. dothidea와 같은 계통군에 속해 있었으며, Botryosphaeria속의 다른 종들과 구분되는 클러스터를 형성하고 있었다. 이 분석 결과를 통해 해당 병원균이 B. dothidea에 속함을 확인할 수 있었다(Fig. 3).

Phylogenetic tree of Botryosphaeria species using combined sequence of internal transcribed spacer region, β-tubulin and elongation factor 1-α gene. The tree was constructed based on neighbor-joining method with 1,000 replicates. *The fungi isolated in this study.
B. dothidea는 국내에서 사과나무, 복숭아나무, 배나무, 포도나무 등의 여러 과수에 열매썩음병과 줄기마름병을 유발하는 것으로 알려져 있으며, 해외에서는 유칼립투스와 피스타치오에서도 발병이 보고되어 있다(Ma 등, 2001). 또한, 국내에서 지금까지 오미자에 병해를 끼치는 것으로 보고된 병원균으로는 Botrytis cinerea, Microsphaera schizandrae, Penicillium sp., Pestalotiopsis guepinii, Phoma sp.가 있고 잎이나 열매에 주로 병징을 나타내는 것으로 알려져 있다(The Korean Society of Plant Pathology, 2009). 그러나, B. dothidea에 의해 나타나는 오미자의 줄기마름병은 지금까지 보고된 바가 없다. 따라서 향후 오미자의 재배에 있어 B. dothidea에 의한 줄기마름병의 방제대책이 필요할 것으로 예상되며, 지금까지 보고되지 않았던 B. dothidea에 의한 오미자 줄기마름병을 국내 처음으로 보고하고자 한다.
Acknowledgement
This research was supported by Cooperative Research Program for Agriculture Science & Technology Development (Project No. PJ010481032015) funded by Rural Development Administration, Republic of Korea.
