발효식품 추출물과 미생물을 활용한 참깨 종자전염성 병 방제
Effect of Extracts and Bacteria from Korean Fermented Foods on the Control of Sesame Seed-Borne Fungal Diseases
Article information
Abstract
참깨 종자전염성 병해를 방제하기 위하여 다양한 유용미생물을 함유하는 김치, 고추장, 된장, 간장, 막걸리를 채집하여 식품 추출물을 조제하고 종자전염성병원균에 대한 억제 효과를 조사하였다. 추가로 식품유래 미생물의 참깨 종자전염성 병해 억제 효과를 in vitro 및 in vivo 조건하에서 조사하였다. 50개 식품추출물에 처리한 참깨 종자를 샤레상에 처리하였을 때 20개 식품추출물이 유묘썩음증상을 92% 이상 감소시켰고, 7개 식품 추출물 처리는 온실조건에서 지상부 출현율을 58.3-66.8% 향상시키는 것으로 나타났다. 여러 발효식품으로부터 얻은 218 종의 발효미생물 중 7종의 종자전염성 병원균에 대하여 높은 항균활성을 보였던 29균주를 처리하여 종자소독효과를 검정 한 결과, 20균주가 병 억제 효과가 있는 것으로 나타났다. 20균주 중 13균주는 모썩음 증상을 유의성 있게 감소시켜 건전주율을 향상시키는 것으로 나타났다. 16S rDNA region의 염기서열분석을 통해 in vitro 및 in vivo에서 항균활성 및 종자소독 효과를 보인 식품유래 유용미생물 16종에 대한 동정을 수행하였다. 그 결과 14균주는 Bacillus 속 세균으로, 막걸리로부터 분리된 2균주는 Saccharomyces 속으로 동정되었다. 발효식품에서 분리된 선발 균주는 대부분 B. amyloliquifaciens 인 것으로 나타났다. 선발 균주 중 B. amyloliquefaciens Gcj2-1와 B. amyloliquefaciens Gcj3-1를 코팅제로 bentonite, kaolin, talc 및 zeolite를 첨가 혼화하여 제제화하였을 때 두 균주 공히 talc 와 kaolin 제형이 억제 효과가 우수하였고 그 다음이 zeolite 제형이었다. 그러나 bentonite 제형의 경우에는 타 제형에 비해 억제 효과가 낮게 나타났다. 선발된 발효식품유래 미생물은 in vitro와 온실조건에서 참깨 종자전염성병 방제에 있어서 효과 적인 것으로 확인되었다. 이상의 결과를 근거로 국내산 발효식품 추출물 및 발효식품 유래 미생물은 참깨 종자소독용 방제제로서 사용될 수 있을 것으로 생각된다.
Trans Abstract
In order to control seed-borne diseases, we obtained extracts from commercial fermented food products of Kimchi, Gochujang, Doenjang, Ganjang and Makgeolli and their suppressive effects against seed-borne diseases were studied. In addition, the suppressive effects of bacterial strains isolated from the fermented foods were screened in vitro and in vivo. Among fifty food extracts, twenty food-extracts suppressed more than 92% incidence of seedling rots in vitro and seven food extracts increased 58.3-66.8% of healthy seedling in the greenhouse. Among 218 isolates from the fermented foods, 29 isolates showing high antifungal activity against seven seed-borne fungal pathogens were selected. Among 29 isolates, 13 isolates significantly reduced seedling rot and increased healthy seedlings. Sixteen isolates with high antifungal activity and suppressive effect against sesame seedling rots were identified by 16S rRNA sequencing. Fourteen of sixteen isolates were identified as Bacillus spp. and the other two isolates from Makgeolli were identified as Saccharomyces cerevisiae. It was confirmed that B. amyloliquifaciens was majority in the effective bacterial population of Korean fermented foods. In addition, when the bioformulations of the two selected effective microorganisms, B. amyloliquifacien Gcj2-1 and B. amyloliquifacien Gcj3-1, were prepared in powder forms using bentonite, kaolin, talc and zeolite, talc- and kaolin-bioformulation showed high control efficacy against sesame seed-borne disease, followed by zeolite-bioformulation. Meanwhile control efficacy of each bentonite-bioformulation of B. amyloliquifacien Gcj2-1 and B. amyloliquifacien Gcj3-1 was lower than that of bacterial suspension of them. It was found that the selected effective microorganisms from Korean fermented foods were effective for controlling seed-borne diseases of sesame in vitro and in the greenhouse. We think that Korean fermented food extracts and useful microorganisms isolated from the extract can be used as bio-control agents for suppressing sesame seed-borne diseases based on above described results.
서론
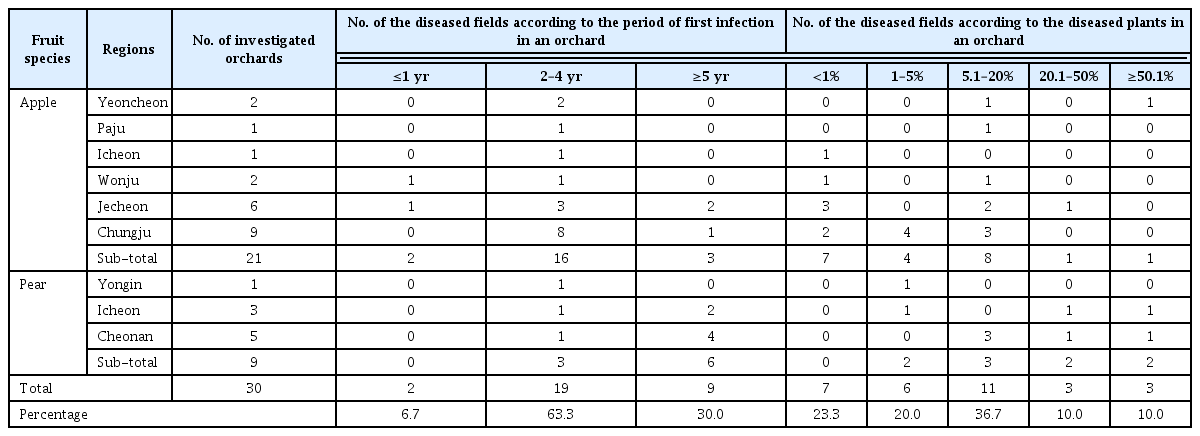
참깨는 대표적인 환금 작물로 가뭄이나 해충의 피해가 적고 보습능력이 우수하고 천연 항산화 물질이 다량 함유하는 것으로 알려져 있다(USDA-NIFA, 2000). 참깨 종자는 재배 및 수확 후 저장하는 과정에서 다양한 식물 병원균에 노출되어 감염되어 피해를 받는다. 특히 참깨 종자가 병원균에 감염되면 발아에 영향을 받아 발아율이 저하되어 작물의 생산성을 저하하는 주요한 요인이 된다(Ahmed 등, 2015). 종자 전염성 병원균은 작물에 따라 종류가 다양하고, 그 피해도 다르다. 참깨종자의 경우 Fusarium sp.를 비롯한 11종의 병원균이 감염되어 발아율을 저하시키고 유묘 생장을 저해하는 것으로 알려져 있다(Altaf 등, 2004). 참깨 종자전염성 병에 대한 방제 방법은 종자소독제인 벤레이트-T 처리에 의한 살균 소독이 가장 일반적인 방법(Lee 등, 1982)이지만 친환경 농업을 실천하는 농가에서는 화학약제의 사용이 제한되므로 이들 종자소독제를 대체할 수 있는 기술 개발이 절실한 실정이다. 현재 화학 농약을 대체할 수 있는 친환경 종자소독 기술로 냉수온탕침법이 활용되고 있는데 이는 종자소독 효과가 우수한 반면 정밀한 온도 유지 및 처리 기간을 맞추기 어려운 단점이 있다(Koch 등, 2010).
따라서 유용미생물이나 식물추출물을 활용하여 종자전염성 병을 생물학적으로 방제하고자 하는 연구가 여러 연구자에 의해 시도되어 왔다. Chung과 Choi(1990)는 참깨 잘록병을 일으키는 Rhizoctonia solani와 Fusarium oxysporum f. sp. sesame를 방제하기 위하여 Trichoderma viride 현탁액에 종자를 처리하였을 때 묘 출현율을 향상시키고 병원균이 억제되는 것을 확인하였고, Choi 등(2014)은 길항성 세균인 Pseudomonas fluorescens M45를 점토와 버미큘라이트를 첨가하여 수화제형으로 제제 화한 다음 종자에 처리하여 발병토양에 재배 하였을 때 묘 출현율을 26% 이상 향상 시킴을 보고하였다. Elewa 등(2011)은 참깨 뿌리썩음병을 일으키는 F. oxysporum f. sp. sesame 방제를 위하여 T. viride, Glomus spp., 비병원성 Fusarium을 처리하였을 때 T. viride의 처리 효과가 가장 우수하였고 비병원성 Fusarium을 처리하고 Glomus를 처리하였을 때 그 뒤를 이었다고 보고하였다. Ryu 등(2006)도 Paenibacillus polymyxa를 점토와 버미큘라이트를 첨가하여 pellet 형태로 제조하여 처리하였을 때 참깨 묘 출현율과 더불어 작물생육 및 수량을 증진한다고 보고하였다. 이 밖에도 Trichoderma 속 진균을 활용한 참깨 종자전염성병 방제 및 생산성 향상에 관한 연구가 일부 보 고된 바 있다(Bharathi 등, 2013; El-Bramawy와 El-sarang, 2012; Sanker와 Jeyarajan, 1996). 대부분의 종자 병해는 여러 가지 병원균에 의해 복합적으로 감염되기 때문에 한두 종의 특정한 미생물을 활용하여 방제할 경우 높은 방제효과를 얻기 어렵다. 한 편, Aspilia africana, Chromolaena odorata와 Tithonia diversifolia 추출물을 처리할 경우 참깨종자 내 점무늬병의 감염율을 현저히 낮출 수 있었다(Enikuomehin, 2005). Afolagboye(2011)는 Aspergillus niger를 비롯한 13종의 참깨 종자전염성 병원균을 대상으로 Zingiber officinale을 포함한 5종의 식물추출물을 처리 할 경우 살균 효과가 우수하다고 보고하였다.
우리나라 고유의 발효식품인 고추장, 된장, 간장, 김치 및 막걸리 등에는 Bacillus subtilis, B. amyloliquefaciens, Saccharomyces cerevisiae 등 다양한 유용미생물이 함유되어 있고, 그 미생물들은 작물의 생육촉진 및 식물병원균 억제와 관련한 다양한 기능을 가지고 있으며(Kim 등, 2014), 일부 미생물은 병원균의 생육을 억제하는 항균활성 물질을 생성하는 것으로 알려져 있다(Ahn, 2009; Baek 등, 2010; Carstens 등, 2003; Chang 등, 2012; Cho 등, 2009; Lee 등, 2008; 2012; 2013; Park 등, 2009; 2013; Yang과 Chang, 2008; Yoon 등, 2005).
발효식품 추출물이나 발효식품 유래 미생물을 처리할 경우 종자 전염성 병을 비롯한 식물병 방제가 가능할 것으로 판단되나 이에 관한 연구보고는 미미한 실정이다. 식품유래 미생물을 활용한 식물병의 생물학적 방제 연구로는 Kim 등(2014)이 발효식품 및 식품유래 미생물을 이용한 벼 종자전염성 병 방제와 Lee 등(2012)이 인삼 점무늬병과 탄저병을 대상으로 된장과 김치 유래 Bacillus 속 세균이 항균활성이 있음을 보고한 바 있다. 따라서 본 시험에서는 다양한 유용미생물을 포함하는 발효식품 추출물과 발효식품 유래 미생물 처리에 의한 참깨 종자 전염성병 방제 가능성을 모색하고자 수행하였다.
재료 및 방법
발효식품 수집 및 유용미생물 분리
발효식품 처리에 의한 종자소독 효과를 구명하기 위하여 시판 또는 농가 자가 제조 식품을 수집하여 미생물을 분리하였다. 김치 14종을 비롯한 총 51종 식품을 수집하였고, 각각의 식품을 희석하여 tryptic soy agar(이하 TSA)상에 평판하여 배양한 후 우점하는 세균을 218 종 수집하여 시험에 사용하였다. 분리된 세균은 멸균된 plastic loop를 사용하여 TSA 배지에 streaking한 뒤 28 °C 인큐베이터에서 배양하였다. 배지 상에 형성된 단일 균총을 선택한 뒤 멸균수에 희석하여 –70 °C 초저온냉동고에 보관하면서 시험에 사용하였다.
발효식품 현탁액 조제
발효식품 처리가 종자발아 및 종자 전염성 병원균에 미치는 영향을 조사하기 위하여 발효식품 현탁액 시료를 조제하였다. 간장과 막걸리는 제품 자체를 원액으로 하였고, 김치 종류는 각각의 김치 국물을 4겹의 cheese cloth 로 걸러 추출한 것을 원액으로 하였으며, 된장과 고추장은 각각 제품 10 g에 살균수를 100 ml 첨가해서 만든 현탁액을 원액으로 하였고, 각각의 발효식품 원액에 살균수를 첨가해서 10배와 100배 희석액을 조제하였다.
종자전염성 병원균에 대한 발효식품의 항균활성 검정
발효 식품의 항균활성은 농업유전자원정보센터(RDA-Genebankinformation center)에서 분양 받았거나 또는 농과원에서 자체 분리 보관하고 있는 종자 전염성 식물병원균을 대상으로 다음과 같이 조사하였다(Agarwal와 Sinclair, 1997). 고추 탄저병균(Colletotrichum dematium, KACC40303), Phomopsis sp.(KACC40333), 땅콩 검은곰팡이병균(Aspergillus niger, KACC40280), 채소류 시들음병균(Fusarium oxysporum, KACC40032), 고추 역 병균(Phytophthora capsici), 고추 검은점썩음병균(Diaporthe sp., KACC40303), 참깨 검은무늬병균(Alternaria sesame, KACC43253)을 대상으로 감자한천배지(Potato dextrose agar, PDA) 상에서 대치배양(dual culture)을 통해서 검정하였다. 종자전염성 병원균에 대한 발효식품의 항균활성은 다음과 같은 방법으로 검정하였다. PDA 배지에 5 mm 지름의 병원균의 균사를 포함하고 있는 agar plug를 PDA 배지의 한가운데 접종한 다음 3 cm 정도 떨어진 곳에 8 mm paper disc를 치상하고 각각의 발효식품 현탁액(원액)을 50 ml씩 점적 처리하였다. 치상한 후 25 °C 배양기에서 5-7일간 배양한 다음 저지원(Inhibition zone)을 측정함으로써 병원균의 균사 생장억제 효과를 조사하였다.
발효식품처리에 의한 종자발아 및 종자전염성 병원균 억제 효과 조사
발효식품 및 발효식품 유래 미생물의 종자소독효과를 구명하기 위하여 수집된 무소독 참깨 종자 중에서 종자발아율이 낮고 병원균 감염율이 높았던 가지깨를 공시하였다. 발효식품 처리가 참깨 종자발아 및 종자에 감염된 병원균 소독에 미치는 영향을 알아보기 위하여 발효식품 추출물(원액)을 조제하고 그 현탁액에 참깨 종자를 50립씩 하루 동안 침지하였다. 살균 수에 세척한 다음 물한천배지(water agar)에 처리구당 13립씩 3반복으로 치상한 후 25 °C 배양기에서 4일간 경과한 후 처리별 종자발아율을 조사하였다. 발효식품처리에 따른 참깨 종자소독효과는 식품현탁액에 종자를 침지처리한 후 13일에 처리별로 발병립률을 조사하였다. 대조구는 참깨 종자 50립을 살균수에 하루 동안 침지한 후 물한천배지(water agar)에 13립씩 3반복으로 치상한 다음 25 °C 배양기에서 4일간 경과한 후 종자발아율을 조사하였다.
발효식품 처리가 참깨 묘 출현율에 미치는 영향조사
온실 조건에서 발아식품 처리가 참깨 지상부 출현율에 미치는 영향을 조사하고자 발효식품 추출물 현탁액 처리시 종자발아 및 종자소독에 우수한 효과를 보인 15종의 식품을 선발하여 시험에 사용하였다. 발효식품별로 각각의 현탁액 원액, 10배 그리고 100배 희석액을 조제하여 그 현탁액 내에 참깨 종자를 하루 동안 침지한 후 음건하여 처리구당 6립씩 3반복으로 60공 연결포트에 파종하였다. 참깨 종자 파종 후 온실로 옮겨 35일간 재배 한 후 처리구별로 지상부 출현율을 조사하였다. 대조구는 참깨 종자를 살균수에 하루 동안 침지한 후 6립씩 3반복으로 60공 연결포트에 파종한 다음 온실로 옮겨 35일간 재배하고 지상부 출현율을 조사하였다.
발효식품 유래 미생물 처리에 의한 참깨 종자 발아 및 병 감 염억제 효과 조사
여러 가지 발효식품으로부터 분리된 218 종 미생물 중 식물 병원균에 대하여 우수한 항균활성을 보인 발효미생물을 29균주 선발하였다. 선발된 29종 미생물을 TSB 배지에서 2일간 배양한 후 각각의 미생물 배양액에 참깨 종자를 50립씩 하루 동안 침지한 후 물한천배지에 처리구당 9립씩 3반 복으로 치상하고 25 °C 배양기에서 9일간 배양한 후 처리구별 종자 발아율을 조사하는 한편, 선발 미생물 처리에 의한 병 억제 효과를 구명하고자 처리구별 발병정도(병 감염률)를 조사하였다. 대조구는 참깨 종자 50립을 살균수에 하루 동안 침지한 후 물한천배지(water agar)에 9립씩 3반복으로 치상한 다음 25 °C 배양기에서 9일간 경과한 후 종자발아율과 병 감염율을 조사하였다.
발효식품 유래 미생물 처리가 참깨 지상부 출현 및 건전묘 율에 미치는 영향조사
In vitro 조건에서 참깨 종자 발아 및 종자소독에 우수한 효과를 보인 발효 미생물을 20종 선발하였다. 선발된 20종 미생물 처리가 참깨 지상부 출현율 및 건전묘율 향상에 미치는 영향을 조사하고자 선발 미생물을 TSB 배지에서 2일간 배양한 후 각각의 미생물 배양액에 참깨 종자를 하루 동안 침지한 후 60공 연결포트에 처리구당 6주씩 3반복으로 파종 하였다. 참깨 종자 파종 후 온실로 옮겨 35일간 재배한 후 처리 구별로 지상부 출현율과 건전주율을 구분하여 조사하였다. 대조구는 참깨 종자를 살균수에 하루 동안 침지한 후 6립씩 3반복으로 60공 연결포트에 파종한 다음 온실로 옮겨 35일간 재배하고 지상부 출현율과 건전주율을 조사하였다.
식품유래 유용미생물 16S r-DNA region의 염기서열분석
참깨 종자전염성 병에 대하여 높은 방제효과를 보인 균주를 대상으로 염기서열 분석을 통하여 종을 동정하였다. 종을 동정하고자 하는 균주의 genomic DNA는 InstaGeneTM matrix(Bio-Rad) 를 이용하여 추출하였다. 16S rDNA 서열분석을 위하여 프라이머 27F 5’(AGA GTT TGA TCM TGG CTC AG)3’과 1492R 5’(TAC GGY TAC CTT GTT ACG T) 3’(Macrogen Inc., 2014)을 사용하였다. PCR 반응은 EF-Taq(SolGent, Korea)을 이용해 조제한 30 ml 반응액에 기질(template)로서 genomic DNA 20ng을 첨가해서 다음과 같이 수행하였다. PCR 반응조건은 95 °C에서 2분간 가열하여 변성을 유도하고, 95 °C 1분, 55 °C 1분 및 72 °C 1분씩 35회 반복하였으며, 최종적으로 72 °C에서 10분 반응시켰다. 증폭된 PCR 산물은 multiscreen filter plate(Millipore corp., MA, USA)를 가지고 정제하였다. 염기서열 분석은 PRISM BigDye Terminator v3.1 cycle sequencing Kit를 이용하여 수행하였다. 증폭된 산물을 포함하는 DNA 시료를 Hi-Di formamide(Applied Biosystems, Foster City, CA)에 첨가한 다음 그 혼합액을 95 °C에서 5분간 유지하고, 이어서 얼음 위에 5분간 정치한 다음 ABI Prism 3730XL DNA analyzer(Applied Biosystems, Foster City, CA)를 이용하여 분석하였다.
참깨 종자소독용 식품미생물의 제제화 및 처리효과 조사
선발한 미생물의 처리효율 및 방제효과 증진을 위하여 각각의 미생물을 tryptic soy agar상에 2일간 접종하여 살균된 loop를 사용하여 회수한 후 살균수를 첨가하여 고농도(109cfu/ml) 미생물현탁액을 조제한 후 코팅제로 사용한 bentonite, kaolin, talc, zeolite 10g에 미생물 현탁액을 20ml씩 첨가하여 골고루 섞은 후 무균상에서 건조시켜 미생물 코팅제를 제조하였다. 미생물 코팅제 처리는 참깨종자를 50립씩 물에 하루 동안 침지한 다음 미생물을 포함하는 코팅제를 사용하여 골고루 피복시켰다. 미생물 코팅제로 피복 처리된 종자를 처리 당 13립씩 3반복으로 페트리디쉬에 치상하고 25 °C 배양기 내에서 6일간 배양한 후 종자 발아 및 병 감염억제 정도를 조사하였다.
결과 및 고찰
종자전염성 병원균에 대한 발효식품의 항균활성
고추 탄저병균을 비롯한 7종의 종자전염성 병원균을 대상으로 간장, 고추장, 된장, 막걸리 및 김치 추출물의 항균활성을 검정한 결과, 식품종류 간에 항균성에 있어서 차이를 보였다(Table 1). 된장, 고추장 및 김치 추출물은 공시한 대부분의 병원균에 대하여 폭넓은 항균활성을 보인 반면, 간장과 막걸리의 경우에는 상대적으로 낮은 항균활성을 보여 된장, 고추장 및 김치가 병 방제용 소재로서의 가능성이 높은 것으로 생각되었다. C. dematium에 대해서는 된장 및 고추장 추출물이 항균활성이 높은 것으로 나타났고, 막걸리와 김치 추출물도 비교적 높은 편이었으며 간장의 경우에는 12제품 중 2제품 추출물만 항균 활성을 보였다. Phomopsis sp.에 대해서는 고추장, 김치, 된장, 막걸리, 간장 순으로 높은 항균활성을 보였다. A. niger과 F. oxysporum의 경우에는 고추장 추출물이 상대적으로 높은 항균활성을 보이긴 하 였으나 다른 병원균에 비하여 높은 항균활성을 보이는 식품추출물은 적었다. P. capsici의 경우에는 간장 추출물을 제외하고는 대부분 추출물이 높은 활성을 보였는데, 특히 김치와 고추장 추출물의 경우에는 시험한 모든 추출물이 항균활성을 보였다. P. capsici에 대해서는 막걸리 추출물과 된장 추출물도 비교적 높은 항균활성을 보였다. Diaporthe sp.의 경우에는 고추장과 된장 추출물에서 높은 항균활성을 보였고, 일부 막걸리와 김치 추출물도 높은 활성을 보였다. 참깨에서 종자전염을 하는 A. sesame의 경우에는 고추장, 된장, 김치 추출물에서 높은 활성을 보였다.
발효식품처리에 의한 참깨 종자발아 및 종자전염성 병원균 억제 효과
발효식품 처리가 참깨 종자발아 및 종자에 감염된병원균 소독에 미치는 영향을 알아보기 위하여 여러 가지 병원 균에 대하여 비교적 높은 항균활성을 보였던 균주들을 포함하는 발효식품 현탁액(원액)을 조제하여 처리한 결과, 대부분의 식품처리에서 종자소독효과가 있는 것으로 나타났으며 종자 발아율도 증가하는 것으로 나타났다(Table 2). 특히 시료 10, 11, 12 간장현탁액, 시료 14, 16, 26 된장현탁액, 시료 20, 21, 24 고추장현탁액, 시료 30, 34 막걸리현탁액, 그리고 시료 38, 39, 40, 41, 43, 44, 45, 46 그리고 49 김치현탁액을 처리하였을 때 종자 감염율을 경감시키고 발아율을 현저히 향상시키는 것으로 나타났다. In vitro 조건에서 발효식품의 희석에 의한 처리효과는 고추장, 김치, 된장 현탁액에서 높은 것으로 조사되어 식품종류에 따라 차이는 있는 것으로 나타났다. 간장의 경우에는 12제품 중 3제품은 병 억제 효과가 매우 우수한 반면 9제품은 억제 효과가 낮은 것으로 나타났는데 이는 발효식품의 종류 및 제품에 따라 유효미생물의 종류와 밀도, 그리고 식품의 염도 등의 차이 에 기인되는 것으로 추정되는데 이에 대해서는 추가적인 연구 가 필요하다고 생각된다.
발효식품 처리가 묘 출현율에 미치는 영향
발효식품 처리가 묘 출현율에 미치는 영향을 알아보기 위하여 in vitro 조건에 서 종자발아 및 종자감염억제 효과가 우수하였던 제품 15종을 선발한 다음 원액, 10배 및 100배 희석액을 조제하여 온실조건에서 처리한 결과, 시료 11과 12 간장 현탁액과 시료 39 김치 현탁액을 제외하고는 대부분의 식품처리에서 묘 출현율을 증가 시키는 것으로 나타났다(Table 3). 특히 시료 16과 26 된장 현탁액, 시료 21 고추장 현탁액, 시료 38, 40, 41, 43, 44, 45, 49 김치 현탁액을 처리하였을 때 유의적으로 참깨 묘 출현율을 향상시키는 것으로 나타났다. 온실 내에서의 발효식품의 희석에 의한 처리효과는 식품현탁액 원액 처리가 희석액 처리에 비해 높은 것으로 조사된 바 식품 현탁액 처리효과는 식품농도 즉 식품 중 미생물의 농도의존적인 것으로 나타났다. 따라서 종자전염을 하는 병원균을 방제할 목적으로 발효식품을 활용할 경우 발효 식품 현탁액을 희석하여 처리하는 것 보다는 고농도로 처리하는 것이 좋을 것으로 판단된다.
발효식품 유래 미생물 처리에 의한 참깨 종자 발아 및 병 감염 억제
여러 가지 발효식품으로부터 분리된 218종 미생물 중 종자전염성 식물 병원균에 대하여 높은 항균활성을 보인 발효미생물 29균주를 공시하여 샤레 상에서 종자발아에 미치는 영향을 조사한 결과(Table 4), 대부분의 미생물 처리에서 종자 발아가 잘되는 것으로 나타났으나 간장에서 분리한 Gj6-1 균주 처리는 발아를 다소 억제하는 것으로 나타났다. 공시한 미생물의 종자소독효과에 있어서는 김치유래 미생물은 Kc2-2 등 6균주, 고추장의 경우에는 Gcj1-4 등 5균주, 된장의 경우에는 Dj2-1 등 4균주, 간장의 경우에는 Gj 1-4 균주, 막걸리의 경우에는 Mkl 6-3균주 등 5균주를 처리하였을 때 종자전염성 병원균의 감염률을 현저히 억제하는 것으로 나타났다. 이상의 결과에서 타 발효식품에 비해 김치, 고추장, 막걸리, 된장, 간장 순으로 종자소독효과가 있는 미생물의 분리빈도가 높은 것으로 생각되었다. Lee 등(2012)은 인삼 점무늬병과 탄저병을 방제하면서 김치에서 분리한 3종의 B. subtilis가 항균활성도 우수하고 병 억제 효과도 높음을 보고하였다. Kim 등(2014)도 전통발효식품과 발효식품에서 분리한 미생물이 종자전염을 하는 병원성 곰팡이에 대한 높은 항균활성을 보이고 벼 종자 전염성 병 억제 효과가 우수함을 보고하였다. 따라서 본 시험에서 높은 병 방제효과를 보인 균주들은 공시한 참깨 이외의 다른 작물에 대해서도 적용이 가능할 것으로 생각된다. Chung와 Choi(1990)는 참깨 모잘록병을 방제할 목적으로 길항성 T. viride를 분리하여 종자에 피복하여 파종하였을 때 참깨 모잘록병을 줄이면서 유묘 출현률을 향상시킴을 보고하면서 T. viride 처리효과는 참깨 생육기간에는 병 억제 효과가 뚜렷하였으나 생육후기에는 그 효과가 감소한다고 보고하였다.
발효식품 유래 미생물 처리가 참깨 지상부 출현 및 건전묘 율에 미치는 영향
In vitro 조건에서 종자발아 및 종자전염성 병원균 감염억제 효과를 보인 20균주의 배양액에 종자를 침지 처리한 후 포트에 파종하여 참깨 지상부 출현율을 조사한 결과 (Table 5), 공시한 김치 및 고추장 유래 미생물은 모두 참깨 지상부 출현율을 향상시켰고, 된장 유래 미생물은 3균주 중 1균주, 막걸리 유래 미생물은 4균주 중 2균주 그리고 간장 유래 미생물은 2균주 중 1균주가 참깨 지상부 출현율을 향상시키는 것으로 나타나 김치 및 고추장 유래 미생물이 된장, 막걸리, 간장 유래 미생물에 비해 지상부 출현에 미치는 영향이 우수한 것으로 조사되었다. 발효식품 유래 미생물 현탁액 처리가 참깨 건전묘율에 미치는 영향을 조사한 결과, 고추장 유래 미생물은 모두 참깨의 건전묘율을 향상시켰고, 김치 유래 미생물은 6균주 중 5 균주가 건전묘율 향상에 효과적인 것으로 나타났다. 반면에 막걸리 유래 미생물은 4균주 중 2균주, 된장유래 미생물은 3균주 중 1균주가 건전묘율을 향상시켰으며, 간장유래 미생물은 2균주 모두 효과가 없는 것으로 조사되었다. 이상의 결과에서 김치 및 고추장 유래 미생물을 처리할 경우 대부분의 경우에 참깨의 지상부 출현율과 건전묘율을 향상시키는 것으로 나타나 고추장과 김치가 참깨 종자전염성 병 방제에 효과적인 소재가 될 수 있을 것으로 판단되며, 선발된 식품유래 미생물은 참깨 건전묘 확보를 위해 유용하게 활용될 수 있을 것으로 판단되었다.
16S r-DNA region의 염기서열분석을 통한 식품유래 유용미생물 동정
16S r-DNA region의 염기서열분석을 통해 in vitro및 in vivo에서 종자전염성병원균에 대하여 항균활성 및 참깨 종자소독 효과를 보인 식품유래 유용미생물 16종을 동정한 결과 (Table 6), 김치에서는 Bacillus sp., B. subtilis 및 B. amyloliquefaciens 가 분리되었고, 고추장에서는 Bacillus sp.와 B. amyloliquefaciens 가 분리되었으며, 된장에서는 B. amyloliquefaciens, 간장에서는 B. subtilis, 그리고 막걸리에서는 S. cerevisiae, B. amyloliquefaciens, B. subtilis가 분리되었다. Jung 등(2011)은 김치의 metagenomic analysis를 통해서 Leuconostoc, Lactobacillus 및 Weissella 등을 주요 기능성 미생물로 보고한 있으나 본 시험에서는 이들 미생물보다는 Bacillus 속 세균이 종자전염성 병원균 방제용 미생물로 선발되었는데 이는 발효과정이 진행됨에 따라 김치 중 미생물 조성이 변화되기 때문으로 추정하나 이에 대해서는 추가적인 연구가 필요하다고 사료되었다. Park 등(2009)은 고추장으로부터 다양한 Bacillus 속 세균이 분리되고 발효단계에 따라 우점하는 종이 다름을 보고하면서 발효 초기단계에서는 B. subtilis, B. licheniformis와 B. amyloliquefaciens가 우점하지만 후기에는 B. pumilus와 B. stearothemophilus가 우점한다고 보고하였다. 본 연구에서 고추장 유래 유용미생물 중 B. amyloliquefaciens만 분리된 것은 잘 발효된 시판 제품을 구입하여 시험에 사용하였기 때문이라 사료된다. Lee 등(2008), Lee 등(2012)과 Carstens 등(2003)이 여러 식물병의 방제제로서의 S. cerevisiae의 사용 가능성을 제시하였는데 본 시험에서는 막걸리 유래 S. cerevisiae 가 항균활성을 보이긴 하나 참깨 종자 전염성 병 방제효과(지상 부 출현율 및 건전묘율)에 있어서 유의적인 차이를 보이지 않아 참깨 종자전염성 병 방제를 위해 S. cerevisiae를 사용하기는 곤란한 것으로 판단되었다. 이는 Kim 등(2014)이 S. cerevisiae가 참깨 종자소독도 우수하여 종자소독제로 개발 가능성이 높은 것으로 보고한 것과는 다른 경향을 보였다. 반면에 Bacillus 속 식품유래 미생물들은 항균활성도 우수하고 참깨 종자 전염성 병 방제효과도 우수하여 참깨 종자소독제로 개발 가능성이 높은 것으로 나타났다. 위와 같이 발효식품 유래 미생물 중 참깨 종자소독 효과를 보이는 미생물은 주로 Bacillus 속 세균임이 확인 되었으며, 김치, 고추장, 된장, 간장 및 막걸리에서 모두 분리되었다. 이상의 결과를 근거로 국내산 발효식품 추출물 및 발효식품 유래 미생물은 참깨 종자소독용 방제제로서 사용될 수 있을 것으로 생각된다. 길항성 미생물에 의한 참깨 종자전염성 병의 생물학적 방제연구는 주로 Trichoderma 속 진균, Pseudomonas 속, Bacillus속 및 Paenibacillus 속 세균, Streptomyces 속 방선균 등이 주로 이용되어 왔다. El-Bramawy와 El-Sarag(2012)는 Trichoderma spp.를 토양 처리할 경우 병 발생을 억제하고 참깨 수량도 증수됨을 보고하였고, Chung과 Choi(1990)는 Trichoderma viride를 참깨 종자에 처리하였을 때 발병을 억제하고 건전묘율을 향상함을 보고하였다. Ziedan 등(2011)은 참깨 종자의 안정생산을 위협하는 참깨 시들음병과 잘록병을 방제하기 위하여 균근균(Glomus spp. 와 Lums spp.)을 처리하여 병 억제 효과를 보고하면서 길항성 Trichoderma viride나 Bacillus subtilis 와 함께 처리하면 효과가 증진됨을 보고하였다. Yuan과 Crawford(1995)은 잘록병 방제를 위하여 Streptomyces lydicus WYEC108 균주를 공시하여 완두종자를 분의 처리하였을 때 병 감염을 경감시킴을 보고하였다. Enikuomehin(2010)은 참깨 종 자전염성 병 방제를 위해 식물추출물을 사용하였을 때 효과가 우수함을 보고하였는데 본 연구에서 선발한 길항성 미생물의 효과 증진을 위해서는 식물추출물을 혼용하는 것도 검토할 필요가 있다고 판단되며, 아울러 bio-priming 기술(Reddy, 2013)을 활용하는 것도 고려해 볼 만하다고 생각한다.
참깨 종자소독용 식품미생물 제제화의 처리효과
참깨 종자발아 및 병 감염억제 효과가 우수하였던 B. amyloliquefaciens Gcj2-1과 B. amyloliquefaciens Gcj3-1균주를 공시하여 bentonite, kaolin, talc 및 zeolite를 부제로 하여 제제화한 다음 참깨 종자발아 및 종자감염 억제정도를 조사한 결과(Table 7), 종자 발아에 있어서는 B. amyloliquefaciens Gcj2-1를 공시하여 제제화하였을 때 zeolite 제제처리에서만 종자발아를 억제하였을 뿐 모든 제제 처리에서 발아가 잘되는 것으로 나타났다.

Effect of fermented food originated microorganisms (FFOMs) on sesame seed germination and sesame seed disinfection when sesame seeds were coated with bentonite, kaolin, talc or zeolite containing FFOMs
종자감염 억제 정도에 있어서는 두 균주 공히 부제로 kaolin 과 talc를 사용하여 제제화 하였을 때 효과가 우수한 것으로 나타났다. Zeolite를 부제로 하여 조제하였을 경우에는 kaolin 제제나 talc 제제에 비해 처리효과가 다소 낮은 경향이었으나 유의성은 없었다. 반면에 bentonite를 부제로 사용하였을 때에는 kaolin, talc, bentonite에 비해 처리효과가 낮은 경향이었고 특히 B. amyloliquefaciens Gcj2-1 균주를 공시하여 제제한 처리에서는 kaolin 제제와 talc 제제가 bentonite 제제에 비해 유의적으로 병 억제 효과가 우수하였다. Bharathi 등(2013)은 참깨 종자전염성 병 방제를 위하여 길항성 Trichoderma, Pseudomonas, Azatobacter를 단독 또는 혼합처리하면서 Trichoderma와 Pseudomonas를 혼합 처리하였을 때 병 경감효과가 가장 효과가 우수하였으나 종자발아에 있어서는 그리 높지 않음을 보 고하였는데, 본 시험에서는 kaolin과 talc제제가 병 경감은 물론 종자발아에도 효과가 우수한 것으로 나타나 향후 활용 가능성이 매우 높다고 판단되었다. Sankar와 Jeyarajan(1996)은 Macrophomina phaseolina에 의한 참깨 잘록병을 방제하기 위 하여 길항성 Trichoderma와 Gliocladium에 talc를 부제로 첨가하여 종자에 처리하였을 때 처리 후 45일까지 길항균 밀도가 유지되었고 120일까지도 50% 이상의 밀도를 유지하였다고 보고하면서 talc를 이용한 Trichoderma와 Gliocladium의 제제 가능성을 높게 평가하였다. Ryu 등(2006)과 Choi 등(2014)은 각각 Paenibacillus polymyxa E681과 Pseudomonas fluorescens M45를 공시하여 부제로 clay와 vermiculite 사용하여 종자커팅 처리하였을 때 참깨 지상부 출현율 및 건전묘율을 향상시킴을 보고하였다. Jeyalaksshmi 등(2013) 종자전염성병을 비롯한 여러 가지 참깨 병해를 방제하면서 길항미생물로 Trichoderma와 님 추출 물을 처리하여 종자 생산을 높이고 병 발생을 줄일 수 있는 방제체계를 보고하였다. Elewa 등(2011)은 참깨 뿌리썩음병을 방제하면서 Bacillus subtilis, Trichoderma viride, 비병원성 Fusarium oxysporum 및 Glomus spp.를 방제제로 처리하여 그 효과를 확인하였다. Nakayama 등(2007)은 Trichoderma asperellum을 이용하여 벼 종자소독용 미생물농약을 개발하여 산업화하였으며, El-Bramawy와 El-darag (2012)도 Trichoderma 속 진균을 처리하였을 때 병 방제는 물론 수량도 증수된다고 보고하였다.
Acknowledgement
This study was carried out with the support of «Research Program for Agricultural Science & Technology Development (Project No. PJ010879032015), National Academy of Agricultural Science, Rural Development Administration, Republic of Korea.