콩 주요 품종에 대한 점무늬병 저항성 평가
Assessing Frogeye Leaf Spot Resistance on Recommended Soybean Cultivars
Article information
Abstract
요약
점무늬병은 콩에서 최대 50% 정도의 수량감소가 보고된 병으로 최근 한국 콩 재배포장에서 큰 문제로 대두되고 있어 최근 6년간의 보급 품종을 대상으로 콩 점무늬병에 대한 저항성 검정을 실시하였다. 표준화된 검정방법을 적용하기 위해 가장 효과적인 포자 형성 배지 조건을 탐색하고 저항성 검정 평가 기준을 확립하였다. 포자형성은 25°C, 12시간 광 조건과 암 조건에 서 V8 juice를 이용한 배지의 포자 형성이 가장 효과적임을 알 수 있었다. 접종은 105 spores/ml로 준비하여, 제 5 복엽 완전전개기인 V6 stage까지 키운 건강한 콩 식물체에 실시하였고 병반응은 28일 동안 관찰하였다. 그 결과 대풍은 8개 균주 모두 저항성을 보였고, 신팔달2호는 7개 균주에, 연풍, 청아는 6개 균주에 저항성을 보였다. 반면에 황금, 태광, 대원, 천상, 신화 등은 평가한 8개 균주에 모두 감수성 반응을 나타내었다. 콩 점무늬병에 대한 저항성 품종을 육종하기 위해 표준화되고 정밀화된 저항성 검정방법과 판정 체계를 갖추는 것은 매우 중요하며 이 방법은 차후 포장 저항성 검정에도 적용할 수 있을 것이라 기대한다.
Trans Abstract
Soybean frogeye leaf spot caused by the fungus Cercospora sojina Hara, has known to lead a severe reduction of crop yield. Since frogeye leaf spot on soybean has recently become a serious problem in Korea, the susceptibility of recent recommended cultivars against C. sojina had been tested. To standardize the disease severity of soybean, the optimum sporulation condition of C. sojina and the disease index were established in this study. Sporulation was maximized on the 10% V8 juice agar with 12 h light and 12 h dark at 25°C. Spore suspension (105 spores/ml) was sprayed on the leaves of soybean (V6 stage), and the disease responses to each isolate were evaluated on 28 days after inoculation. As a result, Daepung, Shinpaldal2ho, Yeonpung and Cheonga showed the resistance reaction to 8, 7, 6, 6 isolates of C. sojina, respectively, whereas Cheongja, Hwangkeum, Taekwang, Daewon, Cheonsang and Sinhwa showed the susceptible reaction to 8 isolates of C. sojina. Breeding the resistant soybean cultivars against C. sojina requires a uniform resistance for screening technique. The disease index of frogeye leaf spot on soybean developed in this study can be effectively used for the accurate field assay to select the frogeye leaf spot resistant soybean.
본문
콩(Glycine max L. Merr)은 우리나라를 포함한 아시아권은 물론 세계적으로 주요한 식량작물로 식량안보차원에서 안전한 생산기반의 확충이 필요한 작물이다. 또한 콩이 함유한 많은 항산화 및 항균활성 물질로 국민들의 콩에 대한 기능성 인식이 증가하면서 수요가 증가하였으나 현재 재배면적은 2013년 80,031 ha로 최근 10년간 재배면적이 증가하지 못하고 있다. 하지만 최근 2011-2013년 ‘논 소득기반 다양화 사업’으로 콩의 논재배면적 비율은 상대적으로 늘어나고 있으며 논 콩 재배는 경지정리에 의한 기계화가 양호하여 노동력 비용을 절감할 수 있고, 콩 재배시 가장 많은 비용을 요구하는 노동력 비용을 절감할 수 있어 논 콩 재배는 증가하는 추세이다(Kim 등, 2011b). 그러나 이러한 논 콩 재배는 습한 논의 특성상 병균에 의한 피해가 더욱 증가하여 논에서의 콩 재배 확산에 걸림돌이 되고 있다. 현재까지 국내에는 진균병 24종, 세균병 4종, 바이러스병 4종이 보고되어 있으며(KSPP, 2009), 그 중 최근에는 진균인 Cercospora sojina Hara에 의한 콩 점무늬병이 가장 큰 문제로 대두되고 있다.
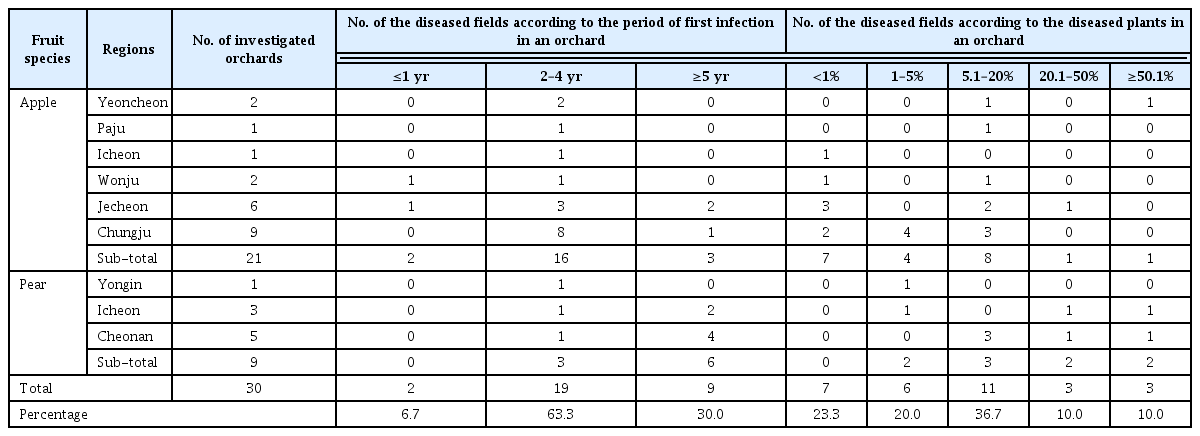
C. sojina에 의해 발병하는 콩 점무늬병은 1915년 일본에서 처음으로 보고가 되었다(Lehman, 1928). 이 병원균은 콩의 잎, 줄기, 꼬투리 및 종자 등 식물이 생장하는 동안 계속 침입이 가능하나 주로 잎에 가장 많이 침입하며, 꽃이 피고 난 뒤 감염되면 수확량에 큰 문제가 된다. 보통은 식물에 병원균이 침입하여 생장하며 식물에 괴사를 일으켜 둥근 반점이 생긴다. 둥근 반점은 식물의 생장과 함께 커지면서 약 1 cm까지 증가하며 반점의 중앙은 회색빛을 띠고 가장자리는 짙은 갈색을 띠게 되어 종종 제초제에 의한 피해와 혼동되기도 한다(Fig. 1). 병징이 심한 경우 콩의 줄기와 꼬투리에서도 병징이 발견되기도 한다. 이러한 병 발생으로 잎이 조기에 탈락하면 광합성작용의 감소로 총 생산량이 감소되기도 한다. 미국의 경우, 본 병으로 인하여 17-21% 정도의 콩 수량 감소가 생겼다는 보고가 있었으며(Laviolette 등, 1970), 브라질 등 주요 콩 생산 국가에서는 본 병으로 10-50%의 콩 수량 감소를 보고하였다(Wrather 등, 2001). 또한 나이지리아의 경우에는 본 병 발생에 의하여 콩 수확이 60% 이상 감소되었다는 보고도 있었다(Dashiell와 Akem, 1991). 국내에서는 1928년에 최초로 본병의 발생이 보고된 이후, 경기북부지방을 중심으로 전국적으로 병 발생이 보고되었으며, 또한 10개의 C. sojina 균주에 대한 총 63개의 한국 콩 품종의 반응을 검정하여 10개의 품종을 판별품종으로 선별하기도 하였다(Kim 등, 2011a). 이러한 노력에도 불구하고 콩 점무늬병의 발생은 지속적으로 증가하여 전국 대부분 지역의 주요 재배 품종에서 병 발생이 확인되었다. 따라서, 콩 점무늬병 저항성 품종 육종의 기초자료를 제공하고자 콩 점무늬병 병 발생 평가표를 제작하였고, 그 평가표를 기반으로 최근 6년간의 장려 품종을 평가하여 저항성 품종을 선별하였다.
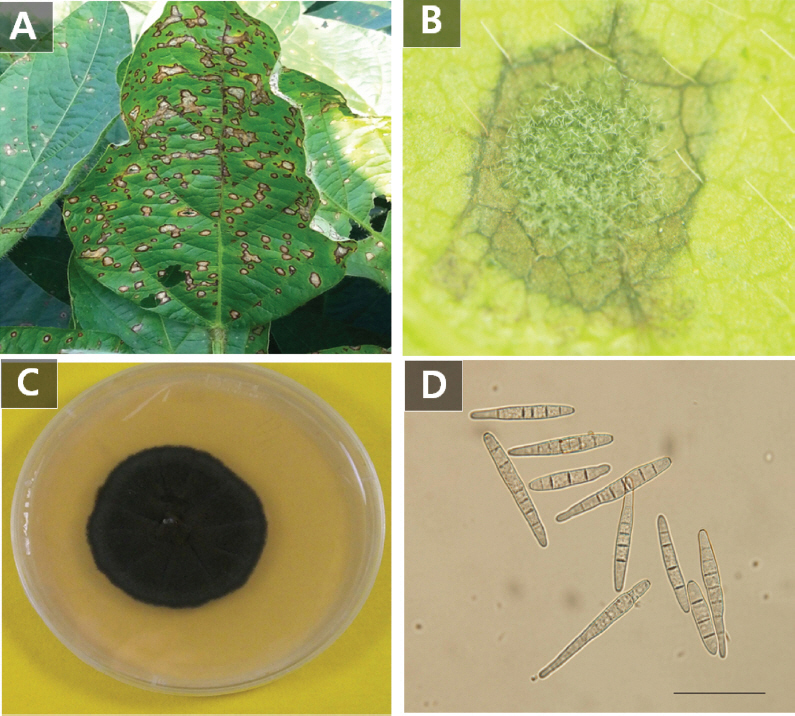
Frogeye symptoms caused by Cercospora sojina on soybean (A) and a magnified image of a spot (B). Mycelial growth of the C. sojina Cs-26 on potato dextrose agar medium at 25°C for 14 days (C) and a microscopic image of spores produced by Cs-21 isolate (D). Scale bar=50 μm.
포자형성 위한 배지 탐색
콩 점무늬병을 검정할 균주 C. sojina 8개 균주는 ‘서울대학교 곰팡이 유전자 은행’(Center for Fungal Genetic Resources, CFGR)에서 분양받아 사용하였으며 (Table 1), 각각의 균주는 PDA(Potato Dextrose Agar, Difco Co.) 배지에서 14일간 배양하여 균사의 생장 정도, 포자의 형태를 검정하고 병원성을 확인한 뒤 사용하였다(Fig. 1). PDA 배지(Potato Dextrose Agar, DIfco Co.), RPA 배지(Rice Polish Agar: rice polish 10 g, sucrose 10 g, agar 10 g, distilled water 500 ml), 10% V8 juice agar 배지(V8 juice 50 ml, agar 7.5 g, 10N NaOH 155 ml, distilled water 450 ml, pH6.7), OAT 배지(Oatmeal Agar medium, Difco Co.) 배지에 옮겨 포자 형성 조건인 25°C, 12시간 light/dark 조건에서 14일간 배양하면서 그 포자의 수를 세었다. 실험한 결과 4개의 배지 중 V8 juice를 이용한 배지에서 월등히 많은 수의 포자가 형성되었다(Fig. 2). V8 juice를 이용한 배지에서는 4일이 지나면서 포자 형성이 시작되었으며 6일 지나며 급격히 그 수가 증가하면서 10일에는 가장 많은 수의 포자형성을 보였다. PDA 배지에서는 4일이 지나며 포자형성을 시작하였으나 그 수가 계속 증가하지 않고 유지하다가 12일 지나면서 증가하기 시작하였다(Fig. 2). OAT에서는 6일이 지나며 포자가 형성하기 시작하였으며 12일 후 급격히 포자형성이 감소하였다. RPA 배지에서는 포자형성이 거의 이루어지지 않았다. 병 검정을 위한 C. sojina 균의 포자형성에는 V8 juice를 이용한 배지가 가장 효과적임을 알 수 있었다.
접종원 준비
병원성 검정을 위해, 포자형성은 각각의 균주를 10% V8 juice agar 배지에 도말한 후 25°C, 12시간 light/dark 조건에서 10일간 배양한 뒤 살균수를 붓고 cell spreader로 균총의 표면을 긁어서 포자 현탁액(105 spores/ml)을 준비하였다.
콩점무늬병 평가표 작성 및 병원성 검정
콩 품종은 건전종자 소독 후 사용하였으며 제 5 복엽 완전전개기인 V6 stage까지 키운 건강한 식물체를 확보한 뒤, 30 ml의 포자 현탁액(105 spores/ml)을 콩의 옆면에 골고루 분무접종하였다(Mengistu 등, 2011). 접종 후 25°C, 습도 100% 조건의 습실상에서 3일 동안 병 발생을 유도 후 온실로 옮겨 진행하였다. 모든 실험 과정은 정밀하고 균일한 환경조성을 위해 온실에서 진행하였다. 또한 다양한 반응에 대한 일관성 있는 분석을 위하여 병 발생 등급을 설정하여 평가표를 작성하였다(Table 2). 병반의 사이즈는 보통 지름 1 mm 미만에서 5 mm까지 형성되며(Dashiell 와 Akem, 1991), 저항성 판정 등급은 Khati 등(2011)이 제시한 등급과 Yorinori(1981)에 의한 병반형 및 병반 수를 참고하여 농업조사분석기준(RDA, 2012)에 맞게 정리하였다. 저항성 판정은 병반 형, 병반 수 및 병반 면적 비율을 고려하여 병원균 접종 14일, 21일, 28일 후, 총 3회 조사한 결과를 통계분석(R project, R-3.0.2)하였고, 균주와 품종간의 저항성 정도를 표로 정리하였다(Table 3). 콩 점무늬병균 C. sojina에 대한 반응은 각 품종에 따라 접종 후 배양 시간에 따라 반응이 다르게 나타났다(Fig. 3). 병징이 거의 보이지 않는 저항성 반응부터 많은 반점이 보이다가 시간이 지남에 따라 반점이 합쳐져 무정형의 괴사 병징을 띠고 급기야는 노랗게 되어 떨어져 버리는 감수성 반응까지 다양한 반응을 관찰할 수 있었다.
콩 보급 품종의 콩점무늬병균에 대한 반응
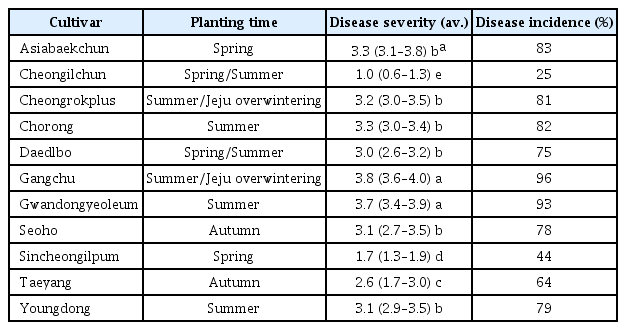
2010년부터 보급품종으로 공시한 품종은 모두 13개 품종(대원, 대광, 황금, 대풍, 풍산나물, 신화, 남풍, 청산, 청자, 풍원나물, 우람, 청아, 연풍)이다. 현재까지 개발된 품종과 신팔달2호 및 가장 최근에 육성된 진풍을 추가하여 병원균에 대한 반응을 검정하였다. 검정할 균은 판별품종을 선별할 때 사용하였던 8개의 균(Table 1)을 분양 받아 사용하였으며 가장 감수성이었던 태광 품종에 대한 반응으로 비교 분석하였다. 13개 보급품종 중 반 정도가 콩 점무늬병균에 대하여 감수성 반응을 보였다(Table 3). 태광, 대원, 천상, 신화, 황금의 경우 접종한 균 8개 균주에 대하여 모두 심한 병징을 보이는 감수성으로 확인되었다. 진풍의 경우 2개 균주에 대하여만 저항성을 보였고 6개 균주에 대해서는 감수성 반응을 보였으며 청자, 남풍, 우람, 풍산나물 등은 3-4개 균주에 대하여 저항성 반응을 보였다. 검정한 품종 중 대풍 품종은 접종한 균 8개에 대하여 모두 저항성을 보였으며, 신팔달2호의 경우 Cs-14 균주에만 감수성을 보였으며 나머지 7균주에 대해서 는 저항성임을 알 수 있었다. 연풍과 청아의 경우는 2개 균주에 대하여 감수성 반응을 보였다. 이는 완전 감수성을 보이는 태광과 황금콩은 모두 광교 모본에서 육종된 것이며 대원, 천상은 황금콩을 모본으로 육종된 것으로 콩 점무늬병균에 대한 저항성 유전자가 전혀 유전되지 않은 것으로 생각된다. 반면, 대풍과 청아 품종은 신팔달2호를 모본으로 육종된 품종으로 콩 점무늬병균에 대해 저항성을 보이는 신팔달2호에서 저항성 형질이 유전된 것으로 추측할 수 있었다. 품종 진풍의 경우 2012년에 개발 육성된 품종으로 신팔달2호를 모본으로 한다. 병원성검정 결과, 총 8균주 중 6균주가 진풍에 병을 발생하였다. 따라서 신팔달2호의 콩점무늬병 저항성 유전자가 다른 콩과 교배하면서 희석된 것으로 추측되어진다.
콩 점무늬병을 일으키는 C. sojina 균은 자낭균문에 속하는 균으로 유성포자인 자낭포자와 무성포자인 분생포자를 가지고 있다. 하나의 병반에서 수십만개의 포자가 형성되며 작물 생육기간 중 환경이 잘 맞으면 2차 또는 3차 감염으로 대발생하게 된다. 이 균은 유전적으로 레이스 변이가 용이하고(Yang과 Weaver, 2001), 현재까지 미국에서는 12개까지 레이스가 보고되어 있으며(Athow 등, 1962), 남미에서는 20개 이상의 레이스가 보고되었다(Yorinori, 1992). 현재 국내에서는 이러한 균의 레이스 분포를 연구한 적이 없어 국내 균의 레이스를 파악하지 못하고 있다. 국내 분포 콩 점무늬병균의 레이스가 파악이 되어야 육종에 사용될 유전자도 선발이 가능하게 된다. 본 실험에서 밝혔듯이 국내 보급품종 중 5개의 품종이 8개의 균주에 대해 모두 감수성을 보이므로 전국에서 균을 수집, 분석하여 보다 명확한 국내 분포균의 레이스를 파악하는 것이 시급하며 표준화된 저항성 평가 시스템을 바탕으로 점무늬 저항성 콩 육종법 개발 이 필요하다고 생각된다.
Acknowledgement
This work was carried out with the support of “Cooperative Research Program for Agriculture Science & Technology Development (Project title: Monitoring and Development of Management Techniques on Fungal and Bacterial diseases of Soybean in Korea, Project No. PJ01119404)” Rural Development Administration, Republic of Korea.