누리대 뿌리 추출물의 고추 탄저병에 대한 항균 및 생장 촉진 활성 검정
Determination of Antifungal Activity on Pepper Anthracnose and Plant Growth Promoting Activity of Pleurospermum camtschaticum Root Extract
Article information
Abstract
본 연구에서는 누리대(Pleurospermum camtschaticum) 뿌리의 추출물을 이용하여 유기농업자재로서의 이용 가능성을 검정하기 위해 실험을 진행하였다. 먼저 누리대 뿌리 추출물을 이용하여 2,2-diphenyl-1-picrylhydrazyl (DPPH) 소거능 활성 및 환원력을 확인하였고, 고추 탄저병을 유발하는 Colletotrichum coccodes, Colletotrichum dematium에 대한 항진균 검정과 고추 종자발아 및 유묘기 생장 촉진 검정을 진행하였다. 생장 촉진 검정이 끝난 직후 처리구별 고추 잎을 채집하여, 고추 잎내의 페놀 함량을 측정하였다. 항산화 활성 검정 결과, 201.92±2.10 μ g/ml에서 DPPH를 50% 이상 제거하였으며 환원력 검정 결과 역시 농도 의존적으로 증가하는 것을 확인하였다. 누리대 뿌리 추출물을 10%, 30%, 50%, 100% 비율로 희석 후에 고추 탄저병 2종(C. coccodes, C. dematium)에 대하여 균사 생장 억제 검정을 진행하였다. 누리대 뿌리 추출물 10% 비율은 2종의 탄저균에 대하여 평균 57.1% 생장 억제율을 기록하였고, 30%, 50% 비율은 농도의존적으로 억제율이 증가하였으며, 원액인 100%에서는 70.3%로 강한 균사 생장의 억제력을 보였다. 고추 열매에서의 탄저균 억제 검정 결과, 앞서 실험한 균사 생장 억제 검정과 동일한 결과가 나타났으며, 탄저균만 접종한 처리구에 비하여 누리대 뿌리 추출물 50%, 100%에서 병반 면적이 80% 이상 감소한 결과를 확인하였다. 전 실험과 동일하게 원액인 100%을 포함한 10%, 30%, 50% 비율을 이용하여 고추 종자 발아 검정 및 고추 유묘기 생장 촉진 검정을 진행하였다. 농도가 낮을수록 종자의 발아가 촉진되었으며, 100% 비율에서는 종자 발아가 억제되는 현상을 보였다. 또한 고추 유묘기 생장 촉진 검정에서는 10% 비율이 대조구에 비하여 약 2배 이상의 생장 차이를 보였으며, 반대로 100% 비율에서는 생장이 억제되는 현상이 관찰되었다. 누리대 뿌리 추출물을 종자 및 식물체에 처리 시 추출물의 농도가 낮을수록 종자 발아촉진 및 식물 생장촉진 효과가 있는 것을 확인하였다. 또한 유묘기 생장 촉진 검정이 끝난 후 처리구별 고추 잎을 채집하여 병원균 항균 활성과 관련이 있는 페놀 함량을 측정한 결과, 10% 비율과 원액인 100% 비율 사이에 유의미한 결과가 나타났다. 따라서 본 연구결과 는 누리대 뿌리 추출물의 향후 유기농자재로서 두 가지 가능성을 확인하였다. 추출물의 농도가 저농도일수록 작물 생장을 촉진시키는 작물 생육용으로서의 가능성을 확인하였다. 추출물의 농도가 고농도일수록 탄저균 균사 생장 억제에 효과적이기에 병해 관리용으로 이용 가능성을 확인하였지만, 종자 발아억제 및 작물에 대한 약해가 심하게 발생하였기에, 병해 관리용으로 사용하기 위해서는 작물생장의 영향이 없도록 더 많은 연구가 필요할 것으로 판단된다. 추가로 토양 내의 누리대 뿌리 추출물 처리 시 유기물 변화 및 microbiome 연구를 통하여 긍정적인 영향이 있다면 토양 개량제로서의 가능성 또한 있을 것이라 판단되며, 상당한 잠재력 가치가 있는 것으로 생각된다.
Trans Abstract
This study was conducted to confirm the utilization of Pleurospermum camtschaticum root extract as an organic agricultural material. Antioxidant activity of P. camtschaticum root extract, closely related to antibacterial activity, increased in a dose-dependent manner. In mycelial growth inhibitory activity, 100% P. camtschaticum root extract supressed over 70% for Colletotrichum coccodes and over 68% for Colletotrichum dematium. In the pepper fruit anthracnose development test, the size of the lesion decreased in a dose-dependent manner, which showed the same tendency as the previous results in inhibitory activity on mycelial growth. In the pepper seed germination and red pepper growth promotion test of P. camtschaticum root extract, oposite results was confirmed. The lower the concentration, the more the seed germination and growth promotion effects were shown. The phenol content of pepper leaves was also measured after pepper growth promotion test have been completed. The phenol content related to antibacterial activity increased in all treated groups compared to the untreated group. Therefore, the results of this study showed the possibility of development as an organic material.
서 론
고추(Capsicum annuum)는 국내 재배되는 작물 중에서 생산 금액이 가장 높은 작물이지만, 수입량, 생산지 면적 감소, 농업의 고령화 등의 문제로 인해 생산의 어려움을 맞고 있으 며, 재배 작기가 길기에 병해에 대한 우려가 큰 작물이다(Park 등, 2012). 고추에 주요 발생하는 병해 중 탄저병(anthracnose)은 수량과 품질에 직접적인 영향을 미치며, 주요 병원균은 총 4종류(Colletotrichum gloeosporioides, Colletotrichum dematium, Colletotrichum coccodes, Colletotrichum acuta-tum)이다(Park과 Kim, 1992). 이러한 고추 탄저병을 방제하기 위해 농가에서는 흑색 멀칭, 저항성 품종 선택 등과 같은 경종적 방법과 살균제를 포함한 화학적 방제를 주로 이용하고 있다(Choi 등, 2006). 특히 살균제를 사용하는 화학적 방제 는 시간이 지날수록 살균제 내성을 가지는 저항성균이 발생하면서 화학적 방제가 더욱 어려워지고 있으며(Park과 Kim, 2017), 살균제 저항성 관리를 위해 다양한 작용기작이 가지는 살균제를 사용해야 한다(Kim 등, 2023). 또한 저항성균 발생뿐만 아니라 잔류농약으로 인한 환경오염, 인축의 독성 피해 등과 같은 여러 문제가 발생하기에 이를 해결하기 위한 대안이 절실히 요구되고 있다(Lee 등, 2014). 유기농업자재 중 식물추출물은 식물 병해충 방제 및 토양 개량과 작물 생장 촉진의 용도로 이용되고 있으며, 이는 화학적 방제를 대체하는 대안이다(Oh 등, 2021). 현재(2023년 6월 기준) 국립농산물품질관리원에 등록된 유기농업자재는 총 1,937종이며, 그중 식물 추출물이 함유된 병해 관리용 자재는 33종(1.7%)에 불과하므로(National Agricultural Products Quality Management Service, 2023). 식물 추출물을 이용한 병해 관리용 자재의 개발이 매우 필요한 실정이다. 본 연구에서 사용한 누리대(Pleurospermum camtschaticum)는 미나리과에 속하는 다년생 작물로서 중국, 일본을 포함한 극동아시아 지역과 러시아 캄차카반도에 주로 분포하며, 한국에서는 설악산 인근 고산지대에 자생하는 것으로 알려져 있다(Kim 등, 1997). 누리대는 과거부터 다양한 생리 활성 연구에 이용되어 왔으며 누리대 지상부 메탄올(methanol) 추출물의 항염 활성, 고지혈증 예방 및 항암 활성, 피부 미백 활성이 보고된 바 있다(Jung 등, 2005; Kim 등, 2012). 특히 누리대 지상부 동결건조물이 목재를 부식시키는 갈색부후균(Tyromyces palustris)의 균사 생장억제에 효과가 있다는 연구 결과 역시 보고되어 누리대의 향후 활용가치가 여러 분야에 걸쳐 매우 높음을 알 수 있다(Cho 등, 2004). 하지만 누리대 지하부의 경우에는 지상부를 3년에 걸쳐 수확한 뒤 대부분은 땅속에 묻혀 활용되지 못하는 것으로 알려져 있으며 이에 따라 관련 학술 연구 역시 활발하지 않은 것으로 확인되었다. 그리고 현재까지 누리대 뿌리 추출물을 이용한 식물병원균에 대한 항진균성 연구는 보고된 바가 없는 실정이다. 본 연구에서는 누리대 지하부인 뿌리의 추출물을 이용하여 고추 탄저병을 일으키는 Colletotrichum coccodes, Colletotrichum dematium 2종에 대한 항진균 검정과 고추 유묘기의 생장 검정을 확인하여 누리대 뿌리의 활용 제시 및 유기농업자재로서의 가능성을 확인하고자 연구를 수행하였다.
재료 및 방법
고추 탄저병 병원균 2종의 배양
고추 탄저병 병원균 2종 Colletotrichum coccodes (KACC 40009), Colletotrichum dematium (KACC 40013)은 국립농업과학원 농업유전자원센터(Korea Agricultural Culture Collection, KACC)로부터 분양받아 사용하였으며, 해당 병원균 곰팡이의 전용 배지인 potato dextrose agar (PDA) 배지에 30 ° C 온도 조건에서 균사체가 Petri dish 90 mm를 다 채울 때까지 배양하여 본 실험에 사용하였다.
누리대 뿌리 추출
본 연구에 사용한 누리대 뿌리는 2021년 여름에 강원도 강릉의 비탈골 농장(Gangneung, Korea)에서 채취하여 사용하였다. 뿌리를 상온에서 7일 동안 풍건하고 2 liter 믹서기를 이용하여 마쇄 후 400 g의 시료를 획득하였다. 온도에 의한 파우더의 손상을 최소화하기 위해 분쇄 시간을 일정 간격으로 나눠서 진행하였다. 4 liter의 메탄올을 이용하여 추출한 뒤 45 ° C에서 회전감압농축을 실시하여 총 80 g의 추출물을 획득하였다. 그리고 멸균수를 이용하여 100,000 μ g/ml (10%), 300,000 μ g/ml (30%), 500,000 μ g/ml (50%)로 희석 및 원액인 1,000,000 μ g/ml (100%)을 이용하여 실험에 사용하였다.
누리대 뿌리 추출물의 항산화 활성 검정
라디칼 소거능 활성은 Xiong 등(1996)의 방법을 참고하여 이를 변형하여 진행하였다. 누리대 뿌리 추출물을 100, 150, 200, 300 μ g/ml 로 제조한 뒤 96-well Petri dish 90 mm에 100 μl씩 분주하고 2,2-diphenyl-1-picrylhydrazyl (DPPH) 시약 (0.15 mM)을 동량 처리한 후 암소에서 30분간 방치한 뒤 515 nm에서 흡광도를 측정하였다. DPPH 소거능 활성은 누리대 뿌리 메탄올 추출물이 DPPH 시약의 프리라디칼을 50% 저해하는 값(IC50)으로 산출하였다.
환원력 검정
환원력 검정은 Oyaizu (1986)의 방법을 변형하여 진행하였다. 누리대 뿌리 추출물을 100, 500, 1,000 μ g/ml 로 제조한 뒤 1.5 ml tube에 100 μl씩 처리하였다. 이후 pH 6.6 sodium phosphate buffer (0.2 M) 100 μl, potassium ferricya-nide (1%) 100 μl, trichloroacetic acid (10%) 100 μl, 0.4 ml의 증류수를 순서대로 혼합한 뒤 0.05 ml ferric chloride를 처리하고 700 nm에서 흡광도를 측정하였다.
누리대 뿌리 추출물의 고추 탄저병 균사 생장 억제 검정
고추 탄저병 2종(C. coccodes, C. dematium)을 대상으로 누리대 뿌리 추출물 원액(100%)을 포함하여, 50%, 30%, 10% 비율로 멸균수에 희석 후 탄저병 균사 생장 억제 검정을 진행하였다. 메탄올 처리구(negative control)는 메탄올 100 μl를 접종하였으며, 처리구는 각각의 비율별 추출물을 100 μl씩 접종한 후, 충분히 PDA 배지에 스며들 때까지 평판도말법(spreading)을 진행하였다. 그 후 고추 탄저병 2종을 5 mm 크기의 cork borer를 이용하여 agar plug를 PDA 배지 정가운데 접종하였다. 더불어 아무것도 첨가하지 않은 PDA 배지에 병원균을 접종한 무처리구의 균사 생장 길이를 기준으로 억제율을 계산하였다. 배지는 27 ° C, 10일간 배양하여 균사체 생장(mycelial growth)의 직경과 억제율을 측정하였으며, 계산식은 다음과 같다.

고추 열매에서의 탄저균 억제 검정
누리대 뿌리 추출물로 고추 열매에서의 탄저병 항진균 억제 검정을 하기 위해 실험을 진행하였다. 고추 탄저균 2종(C. coccodes, C. dematium)은 PDA 배지에서 27 ° C로 7일간 배양한 후 포자 현탁액(1×105 conidium/ml)을 맞추어 실험에 사용하였다. 먼저 고추 열매 ‘품종(Supermanita, Nongwoo Bio, Suwon, Korea)’를 70% 에탄올(ethanol)로 겉면 소독을 진행한 후, 3시간 풍건하였으며, 플라스틱 상자(20.5 cm×14.5 cm×8.8 cm)에 탈지면을 깔아주고 멸균수 25 ml를 주입하였다. 병원균 접종을 위해 멸균된 작은 핀으로 고추 열매당 3부위에 상처를 주고, 무처리구(negative control)은 2종의 탄저균 30 μl를 접종하였다. 누리대 뿌리 추출물 처리구는 먼저 탄저균을 30 μl 접종한 후 1시간 뒤 원액을 포함한 50%, 30%, 10% 비율의 누리대 뿌리 추출물을 탄저균 접종한 동일한 상처에 30 μl씩 접종하여 실험을 진행하였다. 접종 후 플라스틱 상자에 습도를 유지하기 위해 wrap를 씌워 27 ° C에서 5일간 관찰한 후 병반의 면적을 조사하였다.
누리대 뿌리 추출물 처리에 따른 종자 발아 검정
누리대 뿌리 추출물이 고추 종자 발아에 미치는 영향을 확인하기 위해 원액을 포함하여 50%, 30%, 10% 비율로 희석하여 종자 발아 검정을 진행하였다. 실험에 사용된 종자인 슈퍼마니따 ‘품종: 농우바이오’를 70% 에탄올 1분, 1% sodium hypochlorite 1분, 멸균수 4회 세척으로 표면 소독을 진행한 후 clean bench에 24시간 건조 후에 실험에 사용하였다. 소독된 종자를 비율별 누리대 뿌리 추출물에 1시간 침지한 후 다시 꺼내어 clean bench에서 다시 1시간 건조하였으며, Petri dish (지름 90 mm)에 여과지(Whatman no. 1)를 2장 깔아준 후 20립의 종자를 완전임의배치법으로 정렬하였으며, 무처리구는 종자를 멸균수에 1시간 침지 처리한 후 Petri dish (지름 90 mm)에 이식하였다. 실험의 모든 처리구는 1일 1회(멸균수 3 ml) 관수처리 하였고, 생육조건은 28 ° C, 습도 60%, 7일 동안 실험을 진행하였다. 발아율 및 발아된 종자의 생체중을 조사하였고, 계산식은 다음과 같으며, N 은 발아된 총 종자의 수, S는 총 공시종자수이다.
발아율(%) = (N/ S) × 100
누리대 뿌리 추출물의 고추 유묘기 생장 촉진 검정
누리대 뿌리의 비율별 추출물이 고추 유묘기 생장에 미치는 영향을 확인하기 위해 고추 유묘기 생장 촉진 검정을 진행하였다. 고추 종자는 슈퍼마니따 ‘품종: 농우바이오’를 사용하였으며, 원예용 상토(Baroker, Seoul Bio, Eumseong, Korea)를 이용하여 50구 트레이에 파종한 후 발아된 고추 육묘 중 4엽기 이상의 고추 식물체를 선발 및 포트(pot) 이식하여 본 실험을 진행하였다. 실험 조건은 무처리구와 누리대 뿌리 추출물 원액을 포함한 10%, 30%, 50% 비율의 조건으로 실험을 진행하였다. 무처리구는 증류수, 30 ml 처리하였으며, 누리대 뿌리 추출물은 비율별로 30 ml씩 관주처리를 하였다. 28 ° C에서 10일 동안 실험을 진행한 후 고추의 생체중 및 지상부, 지하부 길이, 엽록소를 측정하였다.
고추잎 내 페놀 함량 검정
누리대 추출물이 고추잎 내 페놀 함량에 미치는 영향을 확인하기 위해 고추 유묘기 생장 촉진 검정이 끝난 처리구의 고추잎을 채집하여 총 페놀 함량을 검정하였다. 고추잎의 총 페놀 함량은 Singleton 등(1999)의 Folin-Ciocalteau 실험법을 이용하였으며, 누리대 뿌리 추출물을 1,000 μ g/ml로 제조한 뒤 Folin-Ciocalteau 용액 50 μl와 sodium carbonate buffer (20%) 300 μl를 처리하였다. 그 후 5분간 반응시킨 뒤 725 nm에서 흡광도를 측정하였다. 총 페놀 함량은 10–500 μ g/ml 농도의 gallic acid 표준검량곡선을 이용하여 산출하였다.
통계분석
모든 실험은 3반복씩 수행하였으며, 데이터는 평균값과 표준편차로 나타내었다. 무처리구와 처리구 사이의 통계분석은 IBM SPSS Statistic version 24 software (IBM Corp., Armonk, NY, USA)의 one-way ANOVA를 실시하고 사후 검정은 Duncan's multiple range test를 실시하였다. 유의수준은 P<0.05, P<0.01, P<0.001에서 확인하였으며, IBM SPSS Statistic version 24 software의 독립표본 t-검정을 이용하였다.
결과 및 고찰
누리대 뿌리 추출물의 항산화 활성 및 환원력
누리대 뿌리 추출물의 DPPH 소거능 활성을 검정한 결과 IC50값이 201.92±2.10 μ g/ml로 확인되었다. 또한, 환원력 검정을 통해 누리대 뿌리 추출물의 환원력을 검정한 결과는 Fig. 1과 같다. 환원력 검 정 결과는 흡광도 수치값이 그 시료 자체의 환원력을 보여주며 흡광도의 값이 높을수록 항산화 활성이 높다고 볼 수 있다(Kim 등, 2015). DPPH 소거능 활성과 환원력 활성은 추출물 내 페놀 등의 화합물의 함량과 상관관계가 매우 높다는 이전의 연구 결과가 있었으며 특히 이러한 화합물은 항산화 활성 뿐만 아니라 항균 활성 역시 나타내는 것으로 알려져 있다(Shin 과 Eum, 2021). Jung 등(2007)의 보고에 따르면 호장근이 가장 높은 항산화 활성을 나타내었으며 Pseudomonas aeruginosa, Staphylococcus aureus, Escherichia coli, Klebsiella pneumoniae, Bacillus cereus 등의 균주에 대한 항균 활성 역시 가장 높은 것을 확인하였다. 또한, Kang 등(2010)은 국내 식물자원 40종 추출물의 항산화 활성과 항균 활성을 검정하였으며 결과적으로 가장 높은 항산화 활성을 보인 짚신나물 추출물이 Streptococ-cus iniae에 대하여 가장 높은 항균 활성을 나타냄을 확인하였다. DPPH 소거능 활성과 환원력 검정 결과를 통해 누리대 뿌리 추출물이 페놀을 포함한 다양한 화합물을 함유하고 있으며 (Table 1, Fig. 1) 앞선 다양한 선행 연구와 마찬가지로 누리대 뿌리 추출물 역시 다양한 생리활성, 특히, 항진균활성에 대한 높은 가능성을 확인하였다.
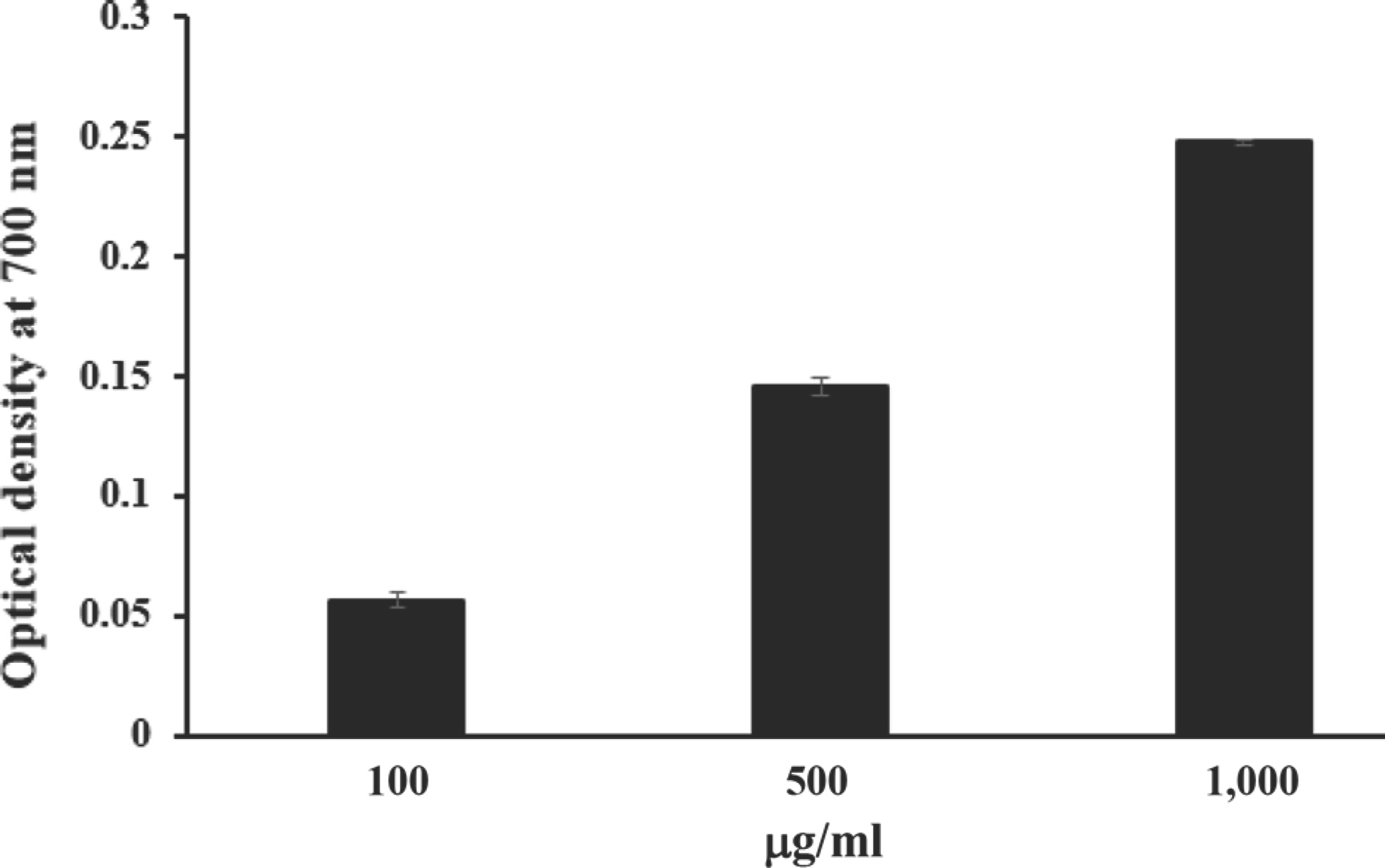
Reducing power assay of MeOH extract from Pleurospermum camtschaticum. Each value was represented as mean±standard deviation.
누리대 뿌리 추출물의 고추 탄저병 균사 생장 억제 검정
누리대 뿌리 추출물을 원액을 포함한 10%, 30%, 50% 비율로 희석하여 실험을 진행하였으며, 더불어 누리대 뿌리 추출에 사용된 메탄올이 균사 생장에 영향을 미치는지 확인하기 위해, 메탄올 및 비율별 누리대 뿌리 추출물 100 μl씩 PDA 배지에 처리한 후 고추 탄저병 2종(C. coccodes, C. dematium)에 대한 균사생장 억제 검정을 진행하였다. 실험 결과, 메탄올의 처리구에서는 균사체 생장 직경이 각각 7.43 cm, 7.50 cm로 나타났으며, 14.2%, 15.4%의 억제율을 나타내었는데, 누리대 뿌리 추출물을 처리한 처리구와 비교했을 시 메탄올이 균사 생장에 대한 영향을 거의 주지 않는 것으로 판단되며(Fig. 2A), 누리대 뿌리 추출물의 100% 처리구에서는 균사체의 직경이 2.47 cm, 2.77 cm, 균사생장 억제율은 71.8%, 68.8%로 억제에 대한 효과가 가장 좋았으며, 희석 비율에 따라 농도 의존적으로 균사 생장 억제를 보여주었다(Fig. 2B). 이러한 결과는 추출시 사용된 용매인 메탄올로 인하여 고추 탄저균 균사 억제가 아닌 누리대 뿌리 추출물에 의해 고추 탄저균의 균사 생장이 억제되고 있음을 시사한다.
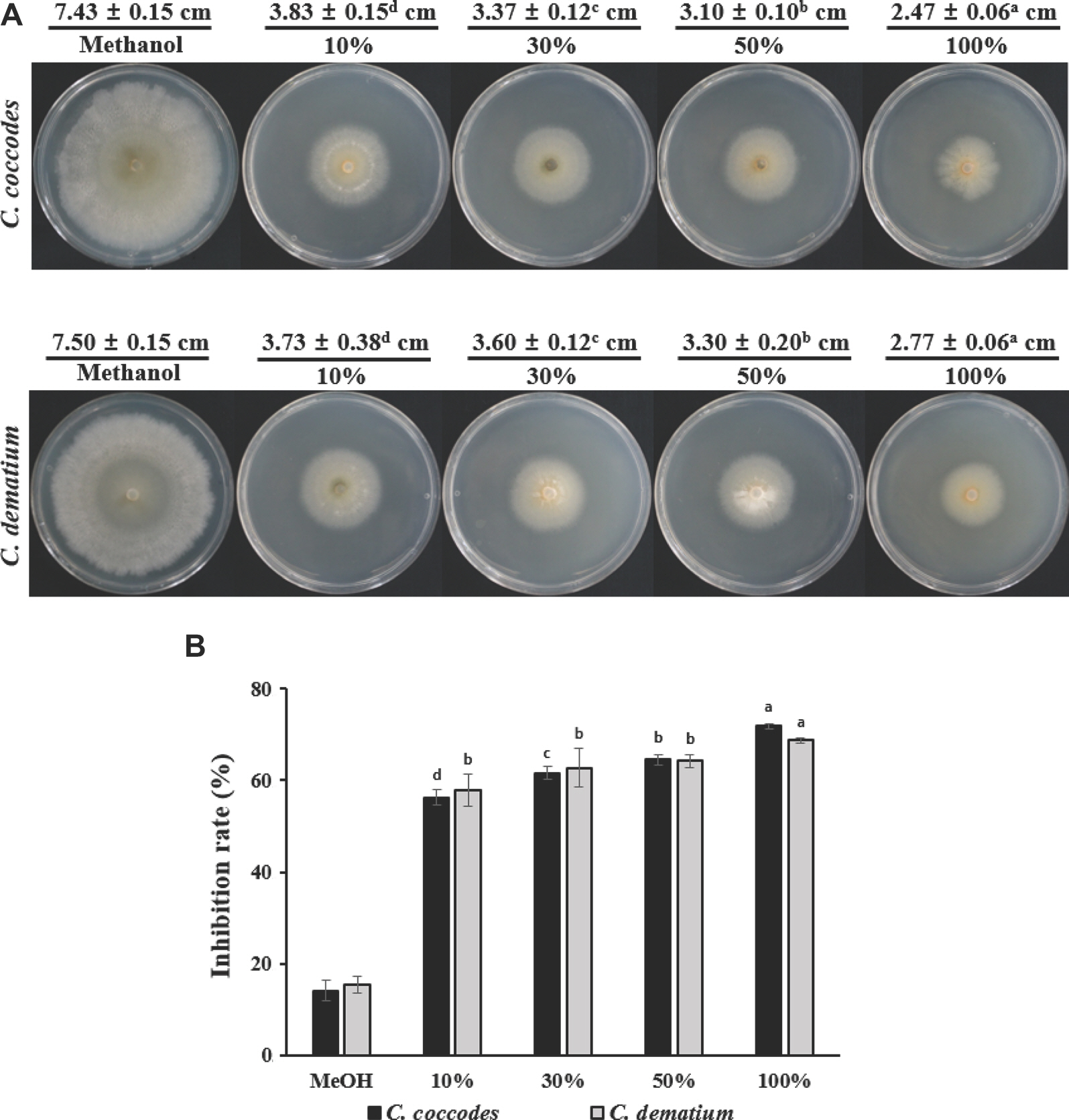
The inhibitory effect on the Colletotrichum coccodes and Colletotrichum dematium mycelial growth of Pleurospermum camtschaticum extracts. (A) The diameter of mycelial growth inhibition was measured when the pathogen was cultured on a potato dextrose agar Petri dish 90 mm at 27 ° C for 10 days. (B) Inhibition rate of mycelial growth was measured at 10 days after inoculation against C. coccodes and C. dematium. Error bars represent standard deviation of three replicates. Each value was represented as mean±standard deviation. Superscripts represented as alphabetical order means difference between the group at P<0.05 with one-way ANOVA and Duncan's multiple range test.
고추 열매에서의 탄저균 억제 검정
누리대 뿌리 추출물로 고추 열매에서의 탄저병 항진균 활성을 검정하기 위해 실험을 진행한 결과, 탄저균만 처리한 negative control 처리구는 고추 탄저균이 표면에 이병되어 육안상의 병반을 확인하였으며, 반면 누리대 뿌리 추출물을 처리한 고추 표면에서는 병반이 관찰되긴 하였으나, 대조구에 비하여 우수한 탄저균의 이병 억제 효과가 나타났다(Fig. 3A). 더불어 병반의 면적을 측정하여 2종의 탄저균에 대한 분석한 결과, 누리대 뿌리 추출물 10%는 대조구에 비하여 병반이 평균적으로 50% 감소하였고, 추출물 30%에서는 67% 감소, 추출물 50, 100%에서는 80% 이상 감소한 결과를 확인하였다(Fig. 3B). 이러한 결과는 앞서 진행한 누리대 뿌리 추출물을 이용한 균사 생장 억제 검정의 결과와 일치하였다.
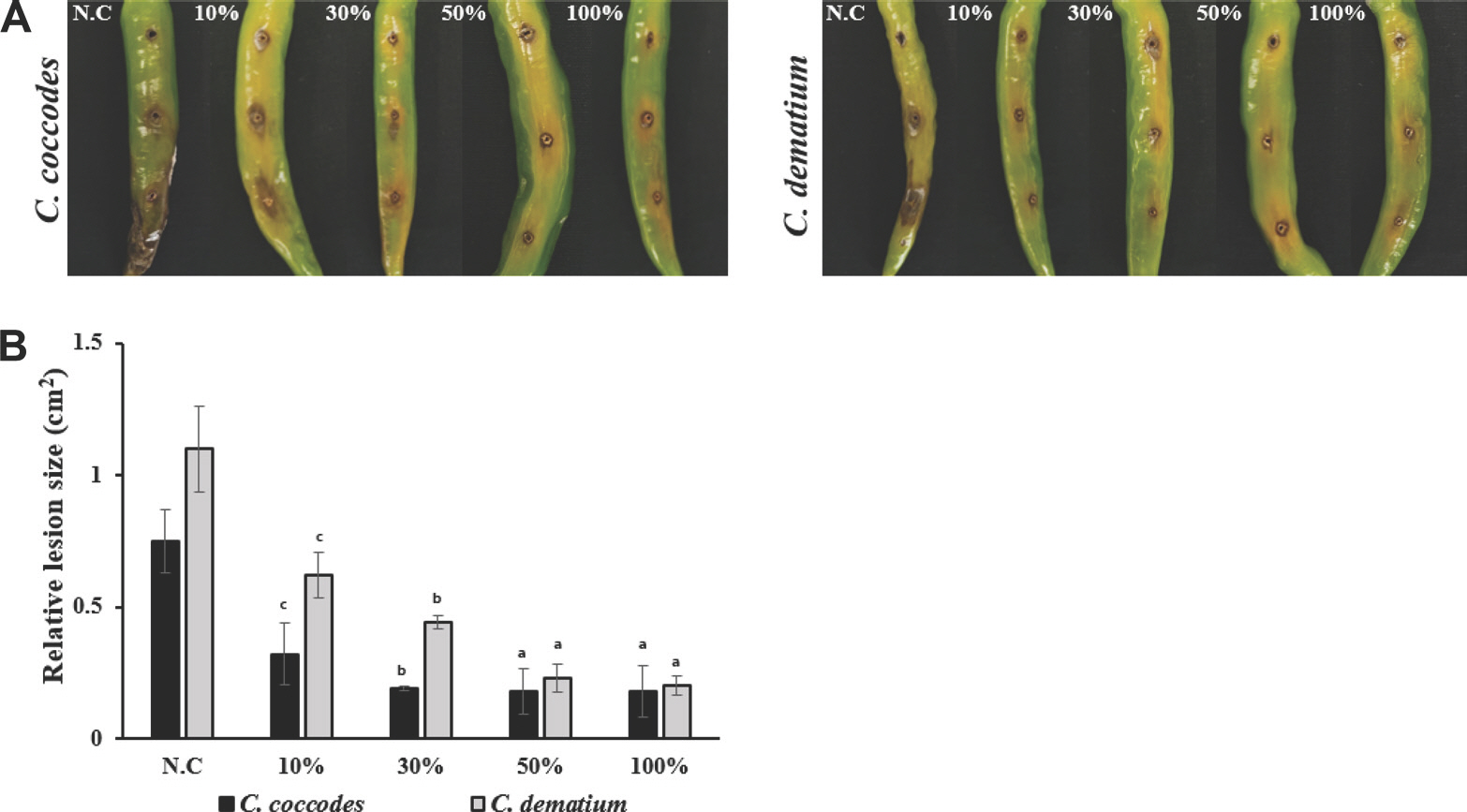
Suppression activity of anthracnose development on pepper fruits by Pleurospermum camtschaticum extracts. (A) The pepper fruits after wiping with alcohol were inoculated with the conidial spores of Colletotrichum coccodes and Colletotrichum dematium. After drying for 1 hr, the pepper fruits were treated with P. camtschaticum Hoffm extracts suspensions. (B) The relative lesion size data is expressed in bar diagram. The relative lesion size was was recorded 7 days after the incubation at 27 ° C. Superscripts represented as alphabetical order means difference between the group at P<0.05 with one-way ANOVA and Duncan's multiple range test. N.C, negative control.
누리대 뿌리 추출물 처리에 따른 종자 발아 검정
누리대 뿌리 추출물이 고추 종자에 미치는 영향을 확인하기 위해, 원액을 포함한 비율별 추출물을 이용하여 종자 발아 검정을 진행하였다. 먼저 육안상으로 고추 종자의 발아가 농도 의존적으로 억제되는 것을 확인하였다(Fig. 4A). 더불어 종자 발아율도 100% 비율에서의 추출물이 종자 발아를 심하게 억제하는 것으로 나타났지만 10% 비율의 처리구에서는 무처리 대조구보다 우수한 발아율을 보였다(Fig. 4B). 그리고 종자의 생체중 또한 10% 비율에서 우수한 생체중을 기록하였다(Fig. 4C). 누리대 뿌리 추출물이 고농도에 가까울수록 종자의 발아를 억제시키며, 저 농도에서는 종자의 발아를 촉진시킨 실험 결과는 앞서 진행한 균사 생장억제 검정 및 고추 열매 탄저병 방제 검정의 결과와 반비례적인 양상을 보였다.
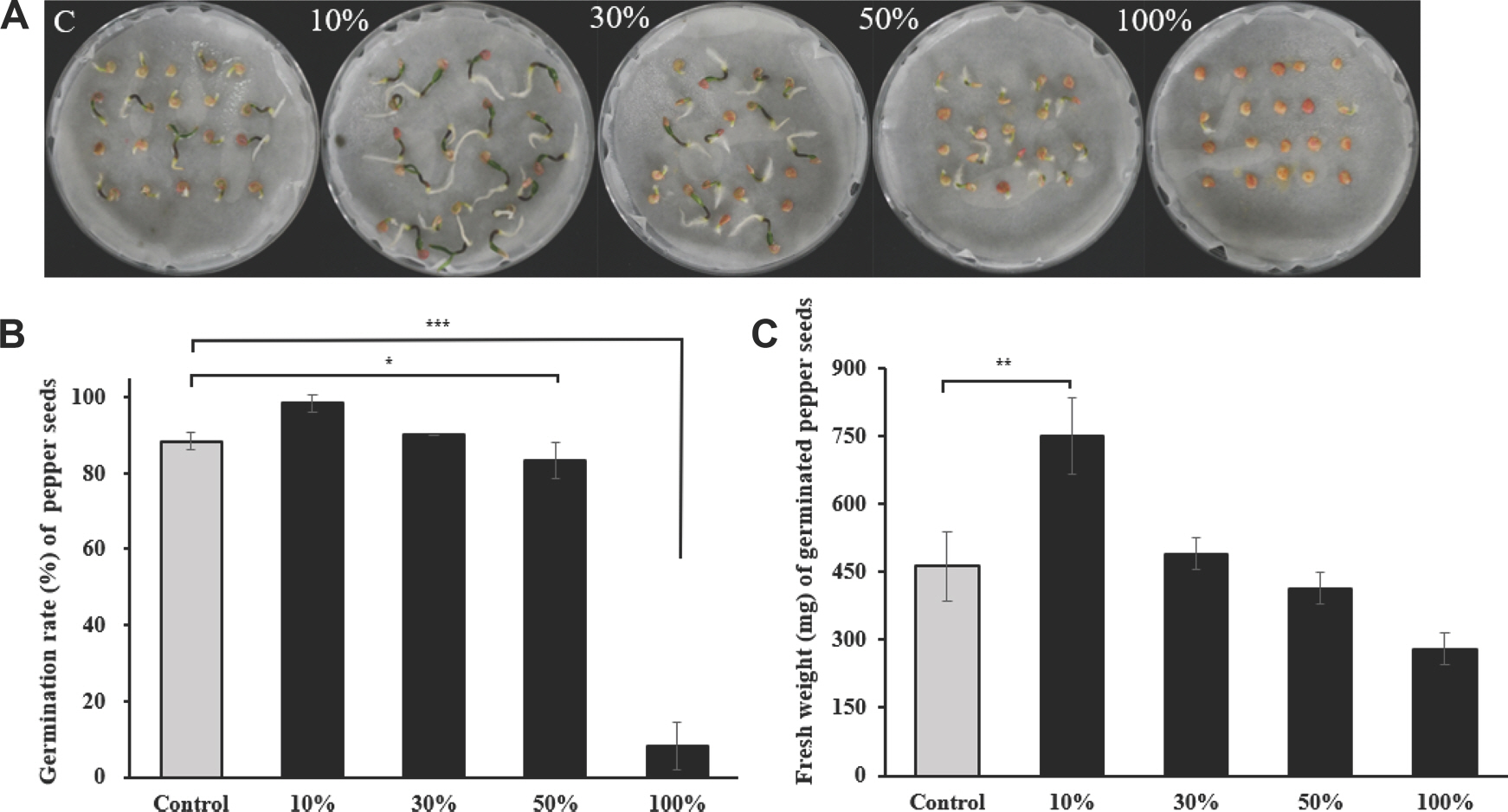
Effect of Pleurospermum camtschaticum extracts on growth promotion of pepper seeds in comparison with the non-treated control under growth chamber conditions. The pepper seeds after soaking in the P. camtschaticum extracts were sown in the Petri dish 90 mm. (A) Visual inspection of pepper seed germination. (B) Pepper seed germination rate. (C) Pepper seeds fresh weigh. Data was measured after 7 days treatment. Superscripts mean significant difference between the control and experimental groups by independent sample t-test (* P<0.05, ** P<0.01, *** P<0.001). C, control.
누리대 뿌리 추출물의 고추 유묘기 생장 촉진 검정
누리대 뿌리 비율별 추출물을 이용하여 고추 식물체 생장 촉진 검정을 진행하였다. 10% 비율의 처리구는 지상부 길이가 무처리구 대비 약 2배 정도의 생장 차이를 보였으며, 50% 비율의 처리구까지도 고추 유묘기 생장을 촉진시키는 결과를 확인하였다(Table 2). 하지만 100% 비율의 처리구는 무처리구에 비하여 생장이 심하게 억제되었는데, 이러한 결과는 앞서 실험 한 종자발아검정 결과와 비슷한 결과로 나타났다. 실제로 식물 추출물은 식물의 생장 촉진제 또는 생장 억제제가 될 수 있는데(Akter 등, 2022), 누리대 뿌리 추출물도 이와 같이 농도에 따라 생장 촉진 및 억제 관련 기작이 있을 것으로 판단되며, 특히 누리대 뿌리 추출물은 10% 이하의 최적 생장 촉진 비율을 확립한다면, 유기농업자재 중 작물 생육용으로 이용 가능성이 높다고 판단된다.
고추잎 내 페놀 함량 검정
고추 유묘기 생장 촉진 검정이 끝난 처리구의 잎을 채집하여 페놀 함량을 측정한 결과, 무처리구 대비 모든 처리구에서 페놀의 함량이 약 2배 가까이 증가하는 것 을 확인하였다(Fig. 5). 이러한 결과는 앞서 진행한 고추 열매의 탄저병 방제 검정에서 누리대 뿌리 추출물에 의하여 병반의 면적이 감소되는 실험 결과와 높은 관련이 있을 것으로 판단된다. 특히 페놀은 이전부터 다양한 항균 효과가 보고된 화합물로서 Park 등(2017)의 연구에서는 항균 효과가 보고된 식물 유래 페놀인 tannic acid를 딸기, 수박 등의 표면에 처리함으로서 운송 중 발생 되는 식물 병원균의 발병을 예방과 동시에 저장 기간을 늘릴 수 있다는 연구 결과를 보고하였다. 이와 더불어 Song 등(1998)은 청미래덩굴 뿌리 메탄올 추출물에서 유래된 다양한 페놀성 화합물이 다양한 식물 병원균에 대한 항균 활성을 확인하였으며, 누리대 뿌리 추출물 역시 천연 살균제를 포함한 유기농자재 중 병해 관리용으로 개발 가능성이 높을 것으로 판단된다.

Total phenol contents of pepper leaves. Estimation of total phenol contents of pepper was conducted after growth promotion experiment was completed. Each value was represented as mean±standard derivation (n=3). GAE, gallic acid equivalent. Superscripts mean significant difference between the control and experimental groups by independent sample t-test (*** P<0.001).
Notes
Conflicts of Interest
No potential conflict of interest relevant to this article was reported.


