서론
경기도 광주지역은 토마토 시설하우스 재배단지를 조성하여 촉성 및 여름작기로 연 2회 완숙토마토를 재배하고 있으나, 계속적인 연작으로 여러 가지 생리장해 및 시설해충, 바이러스 등 병해충으로 과실 안정생산이 위협받고 있다. 시설토마토에 발생하는 주요 해충은 온실가루이, 담배가루이, 토마토녹응애, 총채벌레, 아메리카잎굴파리 등으로 대부분 외래 해충이다. 특히, 온실가루이 (Trialeurodes vaporariorum Westwood)와 담배가루이 (Bemisia tabaci)는 기주 범위가 넓고 시설 내에서 발생 세대수가 많기 때문에 시설 내에 침입 후에는 급격히 피해 밀도가 형성되어 방제가 어렵다(Gorman 등, 2007; Nauen 등, 2002). 온실가루이는 1977년 처음으로 국내에서 발생 보고된 후 전국으로 확산되어 시설재배지에서 피해를 주고 있다(Choe와 Park, 1983). 담배가루이는 세계적으로 최소 24가지의 생태형으로 구분되며, 이 중 MEAM1 (Middle East-Asia Minor 1)과 MED (Mediterranean)는 전 세계적으로 농작물 생산에 가장 심각한 피해를 초래하는 것으로 알려져 있다(Hu 등, 2011; Perring, 2001). 국내에서는 1998년 충북 진천군 시설 장미단지에서 담배가루이 MEAM1이 처음 발견되었고, 2005년 충청이남 지역의 온실에서는 MED의 발생이 확인되었다(Lee 등, 2000, 2005). 경기지역에는 고양시를 제외하고 대부분 담배가루이 MED가 서식하고 있다(Lee 등, 2012). 가루이류는 약충과 성충이 잎을 흡즙하고 감로를 분비하여 생산량을 감소시키는데, 그 보다 심각한 피해는 바이러스 매개로 인한 2차적 피해이다. 담배가루이는 수많은 식물 바이러스의 중요한 매개충이며 대부분은 Begomovirus를 매개한다. 뿐만 아니라 Crinivirus, Ipomovirus, Torradovirus 및 Carlavirus를 포함하여 다른 속에 속하는 여러 바이러스도 담배가루이에 의해 전파 될 수 있다(Navas-Castillo 등, 2011; Polston 등, 2014). 그 중 가장 문제되고 있는 바이러스는 tomato yellow leaf curl virus (TYLCV)이다(Berlinger 등, 1996; Brown 등, 1995; Matsui, 1992; Rubinstein 등, 1999). TYLCV 의 국내 발생은 2007년과 2008년 경남 통영, 거제, 제주, 전북 익산 등에서 발생하여 문제가 되고 있다(Ji 등, 2008; Kwak 등, 2008). TYLCV는 Geminiviridae 과, Begomovirus 속에 속하는 DNA 바이러스로서 TYLCV에 감염된 토마토는 황화, 잎말림 및 위축 등의 증상을 나타내어 생육 초기에 감염되면 거의 수확을 할 수 없을 정도로 막대한 경제적 피해를 준다(Cohen 와 Harpaz, 1964; Czosnek와 Laterrot, 1997; Moriones와 Navas-Castillo, 2000). 최근 국내에서 TYLCV 확산의 추가 원인으로 종자 전염이 보고되었다(Kil 등, 2016).
Tomato chlorosis virus (Crinivirus 속, Closteroviridae 과)는 담배가루이 MED를 포함한 생태형 3종, 온실가루이 2종에 의해 전반될 수 있으며 가루이 종 또는 생태형에 따라 매개능력은 다를 수 있다(Navas-Castillo 등, 2000; Wintermantel과 Wisler, 2006). 대부분 매개충 내에서 tomato chlorosis virus (ToCV) 보독기간은 1-2일로 알려져 있으나 최근 연구에서 온실가루이는 ToCV를 체내 1일 동안만 보유할 수 있지만 담배가루이 MED는 최소 6일 동안 존속할 수 있어 담배가루이 MED가 온실가루이보다 ToCV를 매개하는 능력이 뛰어난 것으로 밝혀졌다(Orfanidou 등, 2016; Simone 등, 1996). ToCV는 2013년에 논산, 익산, 제주, 함평, 화순지역의 토마토에서 처음 발생하였고(Kil 등, 2015), 감염된 식물체는 잎의 불규칙적인 퇴록반점, 엽맥사이 황화 등의 증상이 나타나는데 처음에는 증상이 식물의 아래쪽 부분에 나타나다가 식물이 성숙함에 따라 점차 위쪽 잎으로 진행된다. 또한 광합성 능력을 떨어뜨려 수확량 감소와 조기노화의 원인이 된다. 특히, ToCV는 충남 논산시 토마토에서 TYLCV와의 복합감염이 확인됨에 따라(Choi 등, 2018), 2020년 경기도 광주지역 시설토마토 여름재배 작형에서 TYLCV와 ToCV의 발생 실태조사를 진행하였다. 토마토 생육단계를 토마토 유묘, 착과기 및 수확기로 구분하고 시기별 발생하는 가루이류 분포비율과 보독률, 작물의 감염률을 분석하여 2종 바이러스의 발생양상 및 전염생태 등을 구명하고, 토마토의 생산량 감소 및 고품질 생산의 제한요인이 되는 바이러스병에 대한 근본적인 방제대책을 수립하고자 본 연구를 수행하였다.
재료 및 방법
가루이류의 월별 분포조사 및 동정.
2020년 5월부터 11월까지 7개월 동안 경기도 광주시 시설토마토 재배단지내 (3농가)에서 황색평판끈끈이트랩(15×25 cm, Greenagrotech, Gyeongsan, Korea)을 이용하여 가루이류의 분포비율을 조사하였다. 트랩은 한 달 간격으로 설치하고 트랩에 포획된 가루이는 핀셋으로 떼어 hexane 용액에 담았다. DNA/RNA 추출은 Toyoda 등(2014)의 방법에 따라 가루이 1마리를 1.5 ml 튜브에 옮긴 후, extraction buffer (10 mM Tris-HCl, pH 8.0; 100 mM NaCl; 1 mM EDTA, pH 8.0; 1 mg/ml proteinase K) 30 µl를 혼합하였다. 혼합액을 56° C에서 4-16시간 반응 후 95° C에서 10분간 처리한 뒤 14,500 rpm에서 3분간 원심 분리한 다음 상층액을 DNA/RNA template로 사용하였다.
Polymerase chain reaction (PCR) 분석은 Andreason 등(2017)에 의해 보고된 mtCOI 영역의 프라이머 MED와 Tvap 를 이용하였다. gDNA 2 µl를 넣은 PCR 반응액 20 µl (0.2 mM dNTP, 0.2 µM primer를 각각 1× PCR buffer)에 0.025 U KOD-FX polymerase (TOYOBO, Osaka, Japan)를 이용하여 증폭하였다. PCR 증폭 조건은 C1000 Touch Thermal Cycler (Bio-Rad Laboratories, Hercules, CA, USA)을 이용하여, 94° C에서 10분간 denaturation을 실시한 후 50° C에서 1분간 annealing, 72° C에서 30초 extension 반응을 35회 반복한 후, 4° C에서 반응을 종료하였다. 증폭된 PCR 생산물은 1× TBE buffer를 이용하여 Midori Green Advance (NIPPON Genetics, Co., Ltd., Tokyo, Japan)로 염색한 2% agarose gel로 75 V, 35분간 전기영동하였다. PCR 산물의 크기를 확인하기 위하여 100 bp 혹은 1 kb DNA Ladder (Invitrogen, Carlsbad, CA, USA)를 함께 전기영동 한 후, Gel Doc EZ Gel Documentation System (Bio-Rad Labo-ratories)을 이용하여 확인하였다.
가루이 TYLCV와 ToCV 보독률 조사.
토마토 생육단계별 바이러스 발생양상 조사를 위해 정식 전 토마토 시료 53점, 착과기 53점, 수확기 220점을 수집하였고, 가루이는 정식 전 136마리, 착과기 118마리, 수확기 223마리를 채집하였다.
경기도 광주지역 시설토마토에 피해를 주는 가루이 매개 바아러스 TYLCV, ToCV 에 대하여 Lee 등(2013)에 의해 보고된 다중 진단용 특이 프라이머 TYLCV-M1F (CACGATT-TAATTAGGGATCTTATATCTG)와 TYLCV-1R (ATCAGGGCTTC-GATACATTC), ToCV-M3F (AAG ATCCGCGCTAATGCTAA)와 ToCV-M3R (GTATGAAGGCCGGTTGAAAA)를 이용하여 reverse transcription-PCR (RT-PCR) 방법으로 진단하였다. 역전사 반응은 SuPrimeScript RT-PCR Premix (GenetBio, Daejeon, Korea)를 이용하여 수행하였다. 추출한 total DNA/RNA 2 µl를 주형으로 사용하고 정방향과 역방향 primer 각 1 µl (5-10 pmol/ml)를 첨가한 후 멸균수로 전체 용량을 20 µl로 조정하였다. RT-PCR 반응조건은 반응액을 50° C에서 30분간 항온처리한 뒤 95° C 에서 10분간 denaturation 후, 95°C에서 30초, 55°C에서 40초, 72° C에서 45초로 35회 반복하였다. 반복 후에는 72° C에서 5분간 extension 반응을 진행하였다. RT-PCR 산물의 5 µl를 2% agarose gel (TBE buffer)에 전기영동을 이용하여 증폭 여부를 확인하였다. 증폭된 PCR 산물에 대한 염기서열 분석을 의뢰하였으며(National Instrumentation Center for Environmental Management, Seoul, Korea), 확인된 염기서열은 NCBI BLAST (http://blast.ncbi.nlm.nih.gov/Blast.cgi) 분석을 이용하여 유사성 분석을 수행하였다.
토마토 생육단계별 감염률 및 수량성 검정.
TYLCV와 ToCV 감염이 토마토 수량에 미치는 영향을 조사하기 위해 토마토 여름재배 포장 3개소에서 정식 90일 후인 수확기에 토마토 잎을 무작위로 각각 채집하였다. 채집한 시료는 자동핵산추출시스템인 magLEAD 12gC (Precision System Science Co., Chiba, Japan)를 사용하여 매뉴얼에 따라 시료 0.1 g에서 total DNA/ RNA를 분리하였고, 역전사 반응은 가루이 TYLCV와 ToCV 보독률 조사와 동일한 방법으로 진행하였다. 재배포장별 수량조사는 9월 8일부터 12월 10일까지 수확한 상품과 토마토의 무게를 측정하여 비교하였다.
결과 및 고찰
가루이류의 월별 분포조사 및 동정.
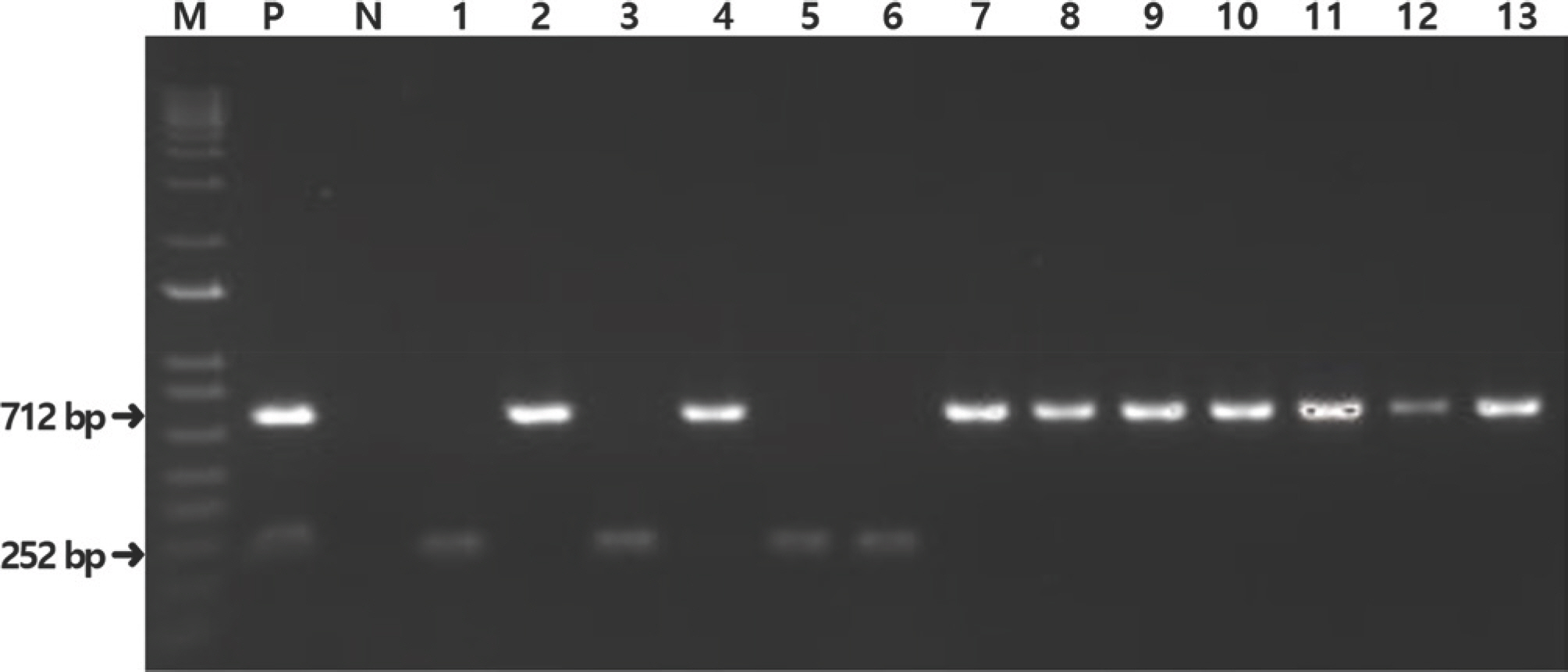
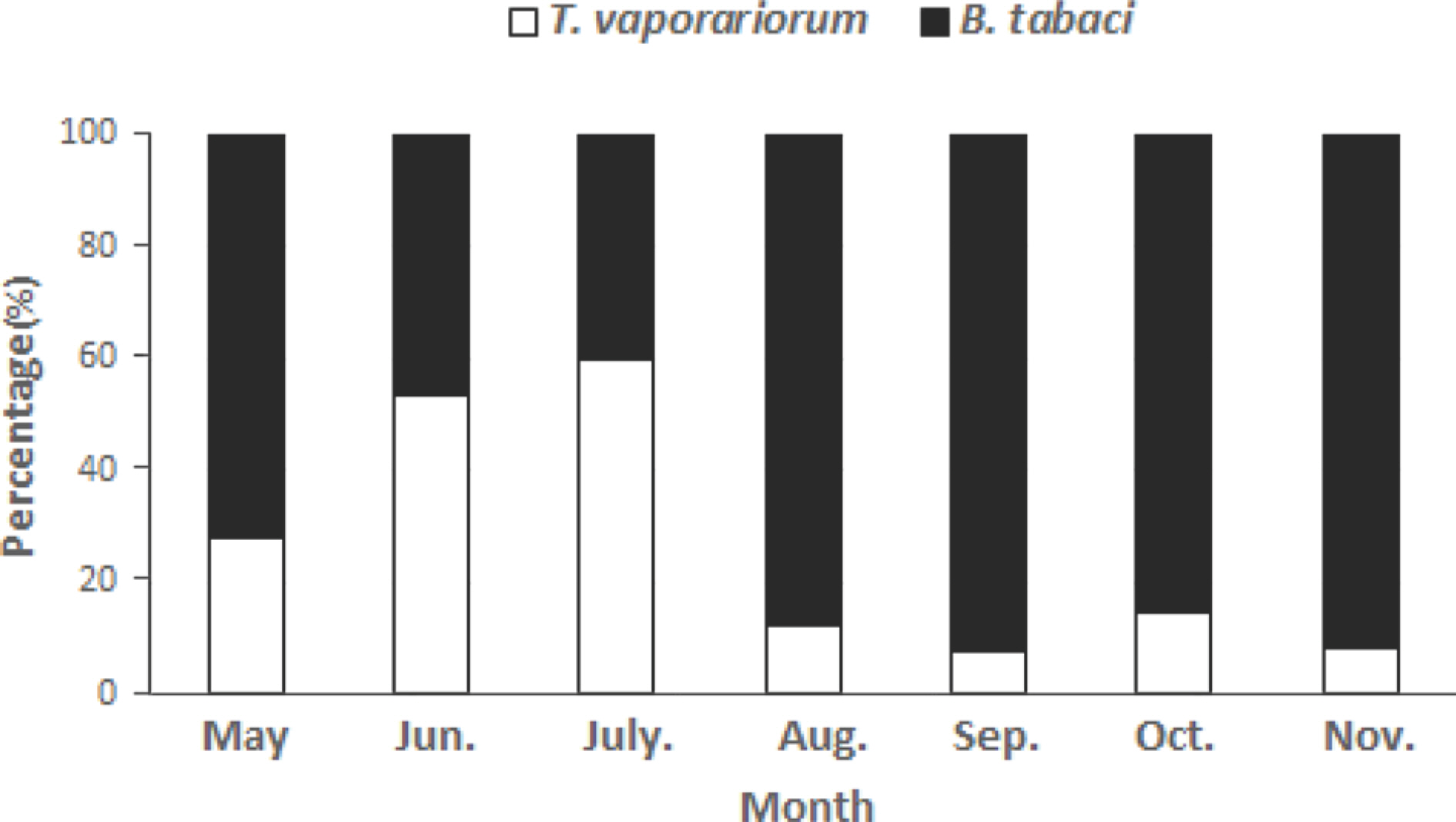
2020년 5월부터 11월까지 7개월 동안 시설토마토 포장에서 채집한 가루이를 분석한 결과 온실가루이와 담배가루이가 혼재되어 발생하였고, 담배가루이의 생태형 분석 결과 모두 MED만 발견되었다(Fig. 1). 일반적으로 MED가 MEAM1에 비해 극한 온도에 대한 내성, 살충제에 대한 저항성이 더 강하며, 일부 스트레스 관련 유전자의 발현으로 새로운 환경에 대한 적응력이 높아 실제 포장에서 MED가 경쟁에서 우위를 갖고 MEAM1을 대체하는 것으로 생각되고 있다(Horowitz 등, 2005; Lee 등, 2012; Mahadav 등, 2009; Pan 등, 2015).
Fig. 1.
Polymearse chain reaction amplification of mtCOI region with specific primers to distinguish the Bemisia tabaci MED and Trialeurodes vaporariorum. Lane M, DNA ladder (1 kb plus; Invitrogen); P, positive control; N, negative control; lanes 2, 4, 7-13, B. tabaci MED; lanes 1, 3, 5, 6, T. vaporariorum. mtCOI, mitochondrial cyto-chrome oxidase subunit I; MED, Mediterranean.
본 연구에서 여름재배기간 내내 온실가루이에 비해 담배가루이의 발생 밀도가 높게 나타났으나 7월 여름재배 정식시기에는 담배가루이의 발생 비율이 다소 감소하는 추세를 보였는데(Fig. 2), 이는 이 시기에 조사농가에서 여름 작기 준비과정에 방제가 이루어진 것으로 판단된다. 가루이 종 및 생태형에 따른 방제효과 비교를 위해서는 시기별 가루이류의 밀도 조사가 필요할 것으로 보인다. 가루이류의 일반적인 방제방법으로는 화학적 방제가 사용되는데, 담배가루이는 온실가루이보다 발육기간이 짧고 연간 발생횟수가 많아서 실제 포장에서 살충제에 대한 저항성 발현 가능성이 높으며(Devine과 Denholm 1998), 특히 MED는 네오니코티노이드 계통과 insect growth regulator (IGR) 계통인 피리프록시펜에 저항성을 나타내는 것으로 알려지고 있다(Kim 등, 2008; Lee 등, 2002). 약제저항성 발달에 따른 방제효율 저하로 인해 농가에서는 고농도 농약을 다량살포하고 있어 저항성 발달을 가속화시키고 있는 실정이다. 따라서, 담배가루이에 방제효과가 우수한 약제를 선발하고, 작용기작이 다른 약제들을 교호적으로 사용하는 것이 필요하다.
토마토 생육단계별 바이러스 감염률 및 보독충률 검정.
수집된 토마토 시료에 대하여 RT-PCR 진단을 수행한 결과 2종(TYLCV와 ToCV)의 바이러스가 검출되었으며, 전체 326점의 시료 중에서 TYLCV는 186점, ToCV는 130점이 양성반응을 보였다(Table 1). GenBank에서 Blast한 결과 TYLCV는 스페인에서 채집된 TYLCV-IL 분리주(accession no. MH680950)와 99%, ToCV는 브라질에서 보고된 ToCV 분리주(accession no. MN172420)와 98% 상동성을 보였다. 토마토 여름재배 작형에서 생육단계를 3단계로 구분하고, TYLCV와 ToCV 감염률 및 가루이 보독율을 조사한 결과(Figs. 3, 4), 정식 전 토마토 모종에서는 3.7% 감염률을 보였고, 착과기까지 7.5%의 감염률을 보였다. 이후 수확기에 접어들면서 감염률의 급격히 증가하여 10월 초에는 88.1%에 달했다. TYLCV의 단독감염률은 30.9%로 ToCV (5.0%)보다 높았고, 복합감염률은 52.2%로 단독감염보다 복합감염이 많은 것으로 나타났다.
Fig. 3.
Multiplex polymearse chain reaction amplification with spe-cies-specific primer sets design for detection of TYLCV and ToCV. Lane M, DNA ladder (100 bp; Invitrogen); P, positive control; N, negative control; lanes 1-7, 9, 11, TYLCV+ToCV; lanes 10 and 12, TYLCV; lane 13, ToCV. TYLCV, tomato yellow leaf curl virus; ToCV, tomato chlorosis virus.

Fig. 4.
Transmission dynamics of TYLCV and ToCV by whiteflies (Bemisia tabaci MED and Trialeurodes vaporariorum) in three of plant growth stages. 1, transplanting stage; 2, fruiting stage; 3-4, har-vesting stage. TYLCV, tomato yellow leaf curl virus; ToCV, tomato chlorosis virus; MED, Mediterranean.
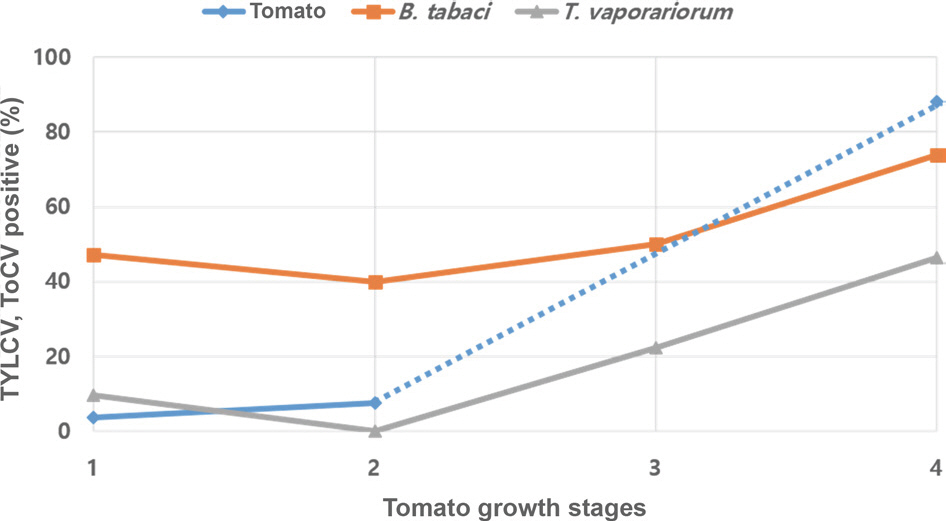
Table 1.
Incidence of viruses of single and mixed infections in summer-cultivated tomato and vectors in greenhouse
| TYLCV | ToCV | TYLCV+ToCV | |
|---|---|---|---|
| Solanum lycopersicum | 70/326 (21.4) | 14/326 (4.2) | 116/326 (35.5) |
| Bemisia tabaci | 81/340 (23.8) | 15/340 (4.4) | 84/340 (24.7) |
| Trialeurodes vaporariorum | - | 10/137 (7.2) | - |
2020년 7월부터 10월에 황색평판끈끈이트랩에 채집된 가루이 477개체의 TYLCV와 ToCV 보독률을 분석한 결과(Fig. 4), 토마토 정식 전 담배가루이의 2종 바이러스 보독률은 47.2%였고, 수확기인 10월에는 채집한 담배가루이 88마리 가운데 65마리가 TYLCV와 ToCV를 복합 보독하여 2종 바이러스 보독률이 73.8%로 급증하였는데, 이는 토마토에 바이러스 감염률 변화와 비슷한 패턴이었다. 반면, 온실가루이의 ToCV 평균 보독률은 7.2%로 담배가루이(28.2%)에 비해 낮아(Table 1) 담배가루이가 ToCV의 주요 매개 역할을 담당하는 것으로 나타났다. 이전 연구에 따르면 담배가루이는 온실가루이보다 ToCV의 전염능력이 높으며 장기간 바이러스를 보유하는 것으로 알려져 있다(Wintermantel와 Wisler, 2006). 식물바이러스와 매개충간의 상호작용은 바이러스의 확산과 곤충의 개체군 역학에 중요한 영향을 끼친다(Stout 등, 2006). 본 연구결과, TYLCV를 보독한 담배가루이는 23.8%, ToCV는 4.4%, TYLCV와 ToCV를 복합으로 보독한 담배가루이는 24.7%로 ToCV를 단독 보독한 담배가루이의 발생빈도가 낮았는데(Table 1), 이는 ToCV가 담배가루이의 생리생태에 직간접적 영향을 미친 결과로 판단된다. Su 등(2015)의 연구에 따르면 TYLCV 감염은 담배가루이 MED의 번식력과 수명을 크게 증가시켰고, 성장에 도움을 주었다. 반면, ToCV 감염은 수명 및 번식률을 저하시키는 것으로 나타났다(Li 등, 2018). 또한 담배가루이 MED는 TYLCV를 단독 보독하거나 TYLCV와 ToCV를 복합 보독했을 때보다 ToCV를 단독으로 보독했을 때 더 많은 면역관련 유전자가 활성화되는 것으로 보고되었다(Ding 등, 2019). 그러므로 본 연구결과에서 토마토에 TYLCV와 ToCV 복합감염의 주된 원인은 이 2종의 바이러스를 복합 보독한 담배가루이 MED의 매개활동에 의한 것으로 생각된다.
바이러스 발생비율 및 수량성 피해.
작물재배 포장에서는 2종 이상의 바이러스가 복합 감염되어 있는 경우가 많으며, 복합감염 시 나타나는 병징 상승효과는 이들 바이러스의 유전자 또는 유전자 산물의 직접적인 상호작용과 기주식물의 변화로 인한 환경적 상호작용, 그리고 면역학적 상호작용에 의해 결정 된다(DaPalma 등, 2010). 1974년부터 미국 조지아주에서 발견된 동부위축병(cowpea stunt disease)은 오이모자이크바이러스(cucumber mosaic virus, CMV)와 동부모자이크바이러스(blackeye cowpea mosaic virus, BICMV)에 의해 발생하는 것으로 이들 바이러스는 단독 감염 시에는 피해가 경미하였으나 복합감염 시 동부 수확량을 86.4%까지 감소시켰다(Pio-Ribeiro 등, 1978). 또한 Mohamed (2010)의 보고에서도 TYLCV 단독감염보다 토마토모자이크바이러스(tomato mosaic virus, ToMV) 또는 CMV와의 복합감염이 병징을 심화시켰고, 토마토생산량도 현저히 감소시켰다.
본 시험에서는 2020년 광주지역 시설토마토 여름재배 작형 수확기에 발생하는 TYLCV와 ToCV의 감염양상을 포장별로 비교해 보았는데(Table 2), 2종 바이러스의 단독감염과 복합감염의 평균 발생률을 보면 단독감염은 35.9%, 복합감염은 52.2%로 시설토마토에서 복합감염에 의한 피해가 많은 것으로 나타났다. 단독감염 발생률을 보면 TYLCV는 평균 발생률이 30.9%로 높았고, ToCV는 5.0%였다. 조사포장별 바이러스 발생률에 따른 수량의 피해정도를 조사한 결과(Table 2), 바이러스 복합감염 정도에 따라 유의성 있는 차이를 보였다. 복합감염률이 13.3%인 경우 6,201 kg/10a, 복합감염률이 77.5%, 63.3%인 포장에서는 각각 3,719 kg/10a과 3,909 kg/10a으로 조사되어 복합감염률이 10% 증감함에 따라 405.4 kg/10a의 수량 감소를 보였다. A포장에 비해 B, C포장에서 복합감염률이 높게 나타난 것은 수확기에 가루이 방제에 실패한 결과로 판단된다. 경기 광주지역에서 생산되는 토마토는 재배 특성상 완숙한 상태에서 매일 수확하다 보니 농약의 안전사용기준을 지키기 어렵고(Choi 등, 2002), 친환경 방제를 시도하였다가 방제효율이 떨어져 실패하는 경우가 많다. 따라서, 토마토의 생산성을 감소시키는 바이러스들의 효과적인 관리체계구축을 위해 바이러스 간의 또는 기주식물과의 상호작용에 관한 연구와 담배가루이 방제적기를 예측할 수 있는 시스템 구축이 필요할 것으로 보인다.
Table 2.
Effect of TYLCV and ToCV infection on yield of summer-cultivated tomato in greenhouses
| TYLCV | ToCV | TYLCV+ToCV | Yield (kg/10a) a | |
|---|---|---|---|---|
| Total | 68/220 (30.9) | 11/220 (5.0) | 115/220 (52.2) | |
| A | 18/60 (30.0) | 10/60 (16.6) | 8/60 (13.3) | 6,201 a |
| B | 9/40 (22.5) | 0/40 (0.0) | 31/40 (77.5) | 3,719 b |
| C | 41/120 (34.1) | 1/120 (0.8) | 76/120 (63.3) | 3,909 c |
이상의 결과를 종합해 보면, 경기 광주지역 시설토마토 재배단지에는 담배가루이 MED가 우점하고 있으며, TYLCV와 ToCV 를 단독 또는 혼합으로 보독하고 있어 TYLCV와 ToCV 감염과 확산의 주요 원인이 된다. 또한 실제 토마토 재배포장에서는 TYLCV와 ToCV의 단독감염보다 복합감염이 많았으며, 복합감염률 증가에 따른 수확량 감소를 확인하였다. 따라서, 여름재배 토마토의 안정생산을 위해서는 수확기에 철저한 담배가루이 방제가 필요할 것으로 판단된다.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print