서론
재료 및 방법
균주 및 생리형(biovar) 검정
식물체 준비
접종원 준비
병원균 접종 및 발병
풋마름병 발생 조사
결과 및 고찰
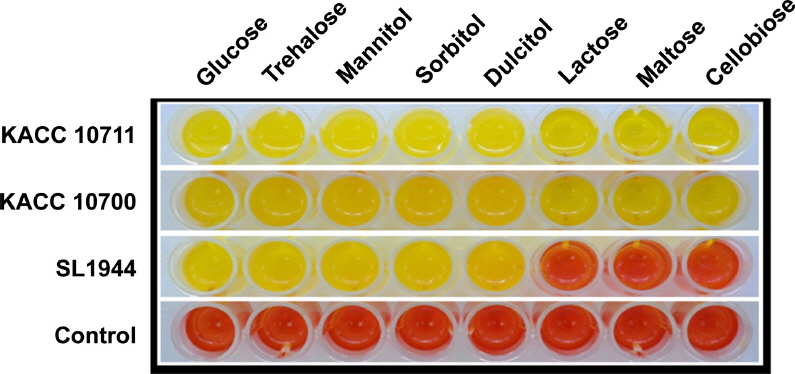
R. solanacearum의 생리형
Fig. 1
접종방법에 따른 고추 풋마름병의 발생
Table 1
| Cultivar | Traitb | Root-dippingc | Soil-drenchingd | Drenching with woundinge | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|
|
|||||||||||
| 5f | 10 | 15 | AUDPCg | 5 | 10 | 15 | AUDPC | 5 | 10 | 15 | AUDPC | ||
| Muhanjilju | MR | 2.2h | 3.0 | 3.2 | 34.0 ai | 0 | 0.5 | 1.0 | 5.0 a | 1.3 | 2.8 | 4.0 | 30.5 ab |
| Meeting | R | 0.8 | 1.0 | 1.5 | 12.8 b | 0 | 0 | 0 | 0b | 0.5 | 2.2 | 3.2 | 21.5 ab |
| Bukang | S | 2.7 | 3.5 | 3.7 | 40.3 a | 0 | 0 | 0 | 0b | 1.8 | 3.5 | 4.0 | 36.5 a |
| Sinsegae | S | 2.3 | 3.2 | 3.5 | 36.3 a | 0 | 0 | 0 | 0b | 3.0 | 4.0 | 4.0 | 45.0 a |
| MC4 | R | 0 | 1.3 | 1.5 | 10.3 bc | 0 | 0 | 0.7 | 1.8 ab | 0 | 0.3 | 1.0 | 4.0 c |
| Subicho | S | 3.0 | 3.2 | 3.5 | 39.8 a | 0 | 0.5 | 0.7 | 4.3 a | 1.7 | 4.0 | 4.0 | 38.5 a |
a One week after transplanting, the potted plants were inoculated with Ralstonia solanacearum (OD600=0.3, 20 ml/pot) by using methods of root-dipping, soil-drenching, and drenching with wounding. The inoculated plants were incubated in a growth chamber (30°C). Five, ten and fifteen days after inoculation, disease severity of the plants was investigated on a scale of 0-4. 0=no symptom, 1=1-25% leaves wilted, 2=26-50% leaves wilted, 3=51-75% leaves wilted, 4=76-100% leaves wilted.
c Seedlings were uprooted and the roots were washed gently in water. The plant were inoculated with the pathogen by dipping the roots in bacterial suspension for 30 min. The infected plants were transplanted into a plastic pot.
d Plants were inoculated with R. solanacearum by pouring the bacterial suspension (20 ml) on soil without wounding.
고추의 생육 시기에 따른 풋마름병 발생
Table 2
| Cultivar | Traitb | 21-day-oldc | 28-day-old | 35-day-old | 42-day-old | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|
|
|
||||||||||||||
| 5d | 10 | 15 | AUDPCe | 5 | 10 | 15 | AUDPC | 5 | 10 | 15 | AUDPC | 5 | 10 | 15 | AUDPC | ||
| Muhanjilju | MR | 0.8f | 2.7 | 3.0 | 25.0 abg | 2.2 | 3.2 | 3.5 | 35.8 ab | 3.8 | 4.0 | 4.0 | 49.0 a | 2.8 | 4.0 | 4.0 | 44.0 ab |
| Meeting | R | 2.3 | 3.0 | 4.0 | 36.5 ab | 1.7 | 3.2 | 3.3 | 32.8 ab | 2.7 | 3.7 | 4.0 | 42.0 ab | 3.0 | 4.0 | 4.0 | 45.0 ab |
| Bukang | S | 2.8 | 3.5 | 4.0 | 41.5 a | 2.8 | 3.8 | 4.0 | 43.0 a | 3.3 | 3.7 | 4.0 | 45.0 a | 3.7 | 4.0 | 4.0 | 48.5 a |
| Sinsegae | S | 2.7 | 3.8 | 4.0 | 42.5 a | 2.2 | 3.8 | 4.0 | 40.0 a | 4.0 | 4.0 | 4.0 | 50.0 a | 3.0 | 3.5 | 4.0 | 42.5 ab |
| MC4 | R | 0 | 0.3 | 0.8 | 3.5 c | 0 | 0.3 | 1.0 | 4.0 c | 0.5 | 1.8 | 2.7 | 18.3 bc | 0.7 | 2.8 | 3.5 | 26.3 bc |
| Subicho | S | 1.2 | 2.7 | 3.5 | 28.3 ab | 2.2 | 4.0 | 4.0 | 41.0 a | 2.0 | 3.8 | 4.0 | 39.0 ab | 3.5 | 3.5 | 3.8 | 44.5 ab |
a One week after transplanting, the potted plants were inoculated with Ralstonia solanacearum by cutting the roots with a scalpel, and then 20 ml of bacterial suspension (OD600=0.3) was applied to soil. The inoculated plants were incubated in a growth chamber (30°C). Five, ten and fifteen days after inoculation, disease severity of the plants was investigated on a scale of 0-4. 0=no symptom, 1=1-25% leaves wilted, 2=26-50% leaves wilted, 3=51-75% leaves wilted, 4=76-100% leaves wilted.
접종원 농도에 따른 고추 풋마름병 발생
Table 3
| Cultivar | Traitb | Inoculum concentration (cfu/ml) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|||||||||||||
| 1.1×108 | 1.1×109 cfu/ml | 2.8×109 cfu/ml | |||||||||||
|
|
|
|
|||||||||||
| 5c | 10 | J5 | AUDPCd | 5 | 10 | 15 | AUDPC | 5 | 10 | 15 | AUDPC | ||
| Muhanjilju | MR | 0.7e | 2.0 | 3.3 | 21.8 abf | 1.7 | 3.3 | 4.0 | 35.0 a | 1.7 | 4.0 | 4.0 | 38.5 a |
| Meeting | R | 1.7 | 3.8 | 4.0 | 37.5 a | 0.8 | 3.2 | 3.8 | 29.5 ab | 0.8 | 3.2 | 3.3 | 28.3 ab |
| Bukang | S | 2.2 | 3.8 | 4.0 | 40.0 a | 3.3 | 4.0 | 4.0 | 46.5 a | 3.3 | 3.8 | 4.0 | 45.5 a |
| Sinsegae | S | 1.5 | 3.7 | 3.8 | 35.5 a | 3.2 | 3.8 | 4.0 | 45.0 a | 2.5 | 3.7 | 3.8 | 40.5 a |
| MC4 | R | 0 | 0.2 | 0.5 | 2.3 c | 0 | 0.8 | 1.8 | 8.5 c | 0 | 1.7 | 2.2 | 14.0 b |
| Subicho | S | 2.2 | 4.0 | 4.0 | 41.0 a | 2.5 | 3.7 | 3.7 | 40.3 a | 2.0 | 3.7 | 4.0 | 38.5 a |
a One week after transplanting, the potted plants were inoculated with R. solanacearum by cutting the roots with a scalpel, and then 20 ml of bacterial suspension was applied to soil. The inoculated plants were incubated in a growth chamber (30°C). Five, ten and fifteen days after inoculation, disease index of the plants was investigated on a scale of 0-4. 0=no symptom, 1=1-25% leaves wilted, 2=26-50% leaves wilted, 3=51-75% leaves wilted, 4=76-100% leaves wilted.
R. solanacearum에 대한 시판 품종들의 저항성
Table 4
| Cultivar | Triatb | Days after inoculation | AUDPCc | rAUDPC (%)d | ||
|---|---|---|---|---|---|---|
|
|
||||||
| 7 | 11 | 15 | ||||
| Bulmat | - | 0e | 0.5 | 1.7 | 5.4 | 12 |
| Dangjomild | - | 0 | 0.2 | 2.7 | 6.2 | 13 |
| Namjajakyuk | R | 0.2 | 1.0 | 1.5 | 8.1 | 18 |
| PM Sinkang | - | 0.3 | 0.8 | 1.8 | 8.5 | 18 |
| Dokyachungchung | - | 0.3 | 1.3 | 1.3 | 9.5 | 21 |
| Gangryeokjosenggeon | - | 0 | 1.5 | 1.8 | 9.6 | 21 |
| PR Cheongyang | - | 0.2 | 1.2 | 2.2 | 10.3 | 22 |
| Ildangbaekgold | - | 0.5 | 1.2 | 1.7 | 11.0 | 24 |
| OK Cheongyang | - | 0 | 1.7 | 2.3 | 11.4 | 25 |
| PR Ssaksseuli | - | 0 | 1.8 | 2.8 | 12.8 | 28 |
| Geumhyang | - | 0.2 | 1.8 | 2.3 | 12.9 | 28 |
| Gukbo | - | 0.2 | 1.8 | 2.7 | 13.7 | 30 |
| Auseong | - | 0 | 2.0 | 3.0 | 14.0 | 30 |
| Bitgoeul | - | 0.2 | 2.3 | 2.3 | 14.9 | 32 |
| Ilsongjung | - | 0.5 | 2 | 2.3 | 15.4 | 33 |
| Shinhong | - | 0 | 2.5 | 2.8 | 15.6 | 34 |
| Buldojang | - | 0.5 | 2.3 | 2.3 | 16.6 | 36 |
| Manseokgun | - | 0.8 | 1.8 | 3.2 | 18.0 | 39 |
| Papiyellow | - | 0.2 | 2.7 | 3.2 | 18.3 | 40 |
| Ganggeon | - | 0.3 | 2.8 | 2.8 | 18.5 | 40 |
| Ilinja | - | 0.7 | 2.3 | 2.8 | 18.7 | 41 |
| Tantandaemok | - | 0.3 | 2.8 | 3.2 | 19.3 | 42 |
| PR Smart | - | 1.2 | 2 | 2.5 | 19.6 | 43 |
| Ildeunggongsin | - | 0.5 | 2.5 | 3.5 | 19.8 | 43 |
| Hanson | - | 0.5 | 2.7 | 3.2 | 20.0 | 43 |
| PR Bulmyul | - | 1.2 | 2.0 | 2.8 | 20.2 | 44 |
| Muhanjilju | MR | 1.0 | 2.2 | 3.0 | 20.3 | 44 |
| Cheonnyeonmannyeon | - | 0.7 | 2.7 | 3.0 | 20.7 | 45 |
| PR Power | - | 0.8 | 2.5 | 3.2 | 20.8 | 45 |
| Sunguja | - | 1.0 | 2.3 | 3.2 | 21.1 | 46 |
| Giribbaksu | - | 0.3 | 3.2 | 3.5 | 21.5 | 47 |
| Gangryeoktaeyang | - | 0.3 | 3.0 | 4.0 | 21.7 | 47 |
| Daejangbu | - | 0.7 | 3.0 | 3.3 | 22.5 | 49 |
| Meeting | R | 0.8 | 3.0 | 3.2 | 22.8 | 50 |
| Matggalchan | - | 1.3 | 2.3 | 3.5 | 23.4 | 51 |
| Dokbulwang | - | 0.8 | 2.8 | 4.0 | 23.6 | 51 |
| Bukang | - | 1.2 | 2.7 | 3.3 | 24.0 | 52 |
| Papired green pepper | - | 0.8 | 3.3 | 3.8 | 25.2 | 55 |
| PR Eokmangum | - | 1.0 | 3.2 | 3.5 | 25.3 | 55 |
| Bongane | - | 1.2 | 3.0 | 3.5 | 25.6 | 56 |
| PR Galmuri | - | 1.0 | 3.3 | 3.5 | 25.7 | 56 |
| PR Ssun | - | 1.7 | 2.5 | 3.2 | 25.8 | 56 |
| Gungyeilhak | - | 1.8 | 2.5 | 3.2 | 26.3 | 57 |
| PR Sanghanga | - | 1.3 | 3.0 | 3.8 | 26.8 | 58 |
| Katagurumai | - | 1.8 | 2.5 | 3.5 | 26.9 | 58 |
| Gusipgujeomgu | R | 2.3 | 2.3 | 2.7 | 27.3 | 59 |
| Hongjanggunbigarim | - | 1.0 | 3.7 | 3.8 | 27.9 | 61 |
| PR Jijon | - | 1.7 | 2.8 | 3.7 | 28.0 | 61 |
| PR Maekom | - | 1.2 | 3.5 | 4.0 | 28.6 | 62 |
| PR Jangwongeubje | - | 1.8 | 3.2 | 3.3 | 29.3 | 64 |
| Chamjoeun | - | 1.8 | 3.3 | 3.3 | 29.7 | 65 |
| Hyangchon | - | 2.3 | 2.5 | 3.8 | 30.3 | 66 |
| Gisedeungdeung | - | 2.2 | 3.0 | 3.2 | 30.5 | 66 |
| Imgeumnim | - | 1.7 | 3.3 | 4.0 | 30.6 | 67 |
| PR Huimangchan | - | 1.5 | 3.7 | 4.0 | 31.1 | 68 |
| PR Pyeongjeong | - | 2.5 | 3.0 | 3.0 | 31.8 | 69 |
| Maekomdalkom | - | 1.7 | 3.8 | 3.8 | 32.2 | 70 |
| Morningput | - | 1.7 | 3.8 | 3.8 | 32.2 | 70 |
| Berodda | - | 1.7 | 3.7 | 4.0 | 32.2 | 70 |
| PR Hwanhoseong | - | 1.8 | 3.7 | 3.8 | 32.3 | 70 |
| Bulsechul | - | 1.8 | 3.7 | 3.8 | 32.3 | 70 |
| Cheonhatongil | - | 1.8 | 3.7 | 3.8 | 32.3 | 70 |
| PR Yeokbalsan | - | 2.0 | 3.5 | 3.8 | 32.6 | 71 |
| Cheonnyeonyaksok | - | 2.2 | 3.3 | 3.8 | 32.9 | 72 |
| Hongsimi | - | 2.0 | 3.7 | 3.8 | 33.4 | 73 |
| Byeonggangse | - | 1.7 | 4.0 | 4.0 | 33.4 | 73 |
| Bacjangdaeso | - | 2.2 | 3.5 | 3.7 | 33.5 | 73 |
| Chukje | - | 2.2 | 3.5 | 3.7 | 33.5 | 73 |
| Geummedal | - | 2.2 | 3.5 | 3.8 | 33.7 | 73 |
| Hat | - | 2.0 | 3.8 | 4.0 | 34.2 | 74 |
| Geochanghan | - | 2.2 | 3.7 | 3.7 | 34.3 | 75 |
| PR Geumsongi | - | 2.3 | 3.5 | 3.8 | 34.3 | 75 |
| PR Sadaechunwang | - | 2.2 | 3.8 | 3.8 | 34.9 | 76 |
| Geumkangseok | - | 2.2 | 3.8 | 3.8 | 34.9 | 76 |
| Yeokganghongjanggun | - | 2.0 | 4.0 | 4.0 | 35.0 | 76 |
| PR Geummaek | - | 2.3 | 3.7 | 3.8 | 35.1 | 76 |
| Onggolchan | - | 2.8 | 3.2 | 3.5 | 35.2 | 77 |
| Yeppeundokyacheong | - | 2.3 | 3.8 | 3.8 | 35.5 | 77 |
| PR Daedeulbo | - | 2.3 | 3.8 | 4.0 | 35.9 | 78 |
| Shintolil | - | 2.5 | 3.7 | 3.7 | 36.0 | 78 |
| Subiyeok | - | 2.8 | 3.3 | 3.7 | 36.0 | 78 |
| PR Geumnara | - | 2.5 | 3.8 | 3.8 | 36.6 | 80 |
| Jinmi | - | 2.5 | 3.8 | 3.8 | 36.6 | 80 |
| Najalran | - | 3.0 | 3.3 | 3.5 | 36.7 | 80 |
| PR Bulrocho | - | 2.3 | 4.0 | 4.0 | 36.7 | 80 |
| Jeongukilju | - | 2.3 | 4.0 | 4.0 | 36.7 | 80 |
| Wanggeon | - | 2.7 | 3.7 | 3.7 | 37.1 | 81 |
| Josaengsintap | - | 2.7 | 3.7 | 3.8 | 37.3 | 81 |
| Shinsegae | - | 2.7 | 3.7 | 4.0 | 37.7 | 82 |
| PR Geosang | - | 2.8 | 3.7 | 3.8 | 37.8 | 82 |
| Dahongchima | - | 3.2 | 3.3 | 3.5 | 37.8 | 82 |
| Duruduru | - | 3.2 | 3.3 | 3.5 | 37.8 | 82 |
| PR Sangseang | - | 2.8 | 3.7 | 3.8 | 37.8 | 82 |
| PR Bultina | - | 2.5 | 4.0 | 4.0 | 37.8 | 82 |
| PR Bulkkeun | - | 3.0 | 3.5 | 3.8 | 38.1 | 83 |
| Hongmiin | - | 2.8 | 3.8 | 4.0 | 38.6 | 84 |
| New wave green pepper | - | 2.8 | 3.8 | 4.0 | 38.6 | 84 |
| PR Hongduke | - | 2.7 | 4.0 | 4.0 | 38.9 | 85 |
| PR Geumgochu | - | 3.0 | 3.7 | 4.0 | 39.3 | 85 |
| Hongboseok | - | 2.8 | 4.0 | 4.0 | 39.4 | 86 |
| Taesan | - | 2.8 | 4.0 | 4.0 | 39.4 | 86 |
| Hanbando | - | 3.0 | 3.8 | 4.0 | 39.7 | 86 |
| Gidaemanbal | - | 3.2 | 3.7 | 4.0 | 40.4 | 88 |
| Dabotap | - | 3.0 | 4.0 | 4.0 | 40.5 | 88 |
| PR Manse | - | 3.0 | 4.0 | 4.0 | 40.5 | 88 |
| PR Manitta | - | 3.3 | 3.7 | 3.8 | 40.6 | 88 |
| Yeongyangmat | - | 3.2 | 3.8 | 4.0 | 40.8 | 89 |
| Hangaram | - | 3.3 | 3.8 | 4.0 | 41.4 | 90 |
| Mansahyeongtong | - | 3.2 | 4.0 | 4.0 | 41.6 | 90 |
| PR Manjangilchi | - | 3.2 | 4.0 | 4.0 | 41.6 | 90 |
| NW Bigarim | - | 3.2 | 4.0 | 4.0 | 41.6 | 90 |
| Anjeonbelteu | - | 3.5 | 3.7 | 3.8 | 41.7 | 91 |
| Haengun | - | 3.3 | 4.0 | 4.0 | 42.2 | 92 |
| Johyang | - | 3.3 | 4.0 | 4.0 | 42.2 | 92 |
| Geumgoeul | - | 3.7 | 3.5 | 4.0 | 42.4 | 92 |
| Buchon | - | 3.5 | 3.8 | 4.0 | 42.5 | 92 |
| Chammani | - | 3.7 | 3.8 | 3.8 | 43.2 | 94 |
| Geumbit | - | 3.5 | 4.0 | 4.0 | 43.3 | 94 |
| Obok | - | 3.5 | 4.0 | 4.0 | 43.3 | 94 |
| Hanpanseung | - | 3.5 | 4.0 | 4.0 | 43.3 | 94 |
| PR Gukgadaepyo | - | 3.5 | 4.0 | 4.0 | 43.3 | 94 |
| Giunchan | - | 3.5 | 4.0 | 4.0 | 43.3 | 94 |
| Ilpyeondansim | - | 3.5 | 4.0 | 4.0 | 43.3 | 94 |
| Segyeil | - | 3.7 | 3.8 | 4.0 | 43.6 | 95 |
| Geummaru | - | 3.7 | 3.8 | 4.0 | 43.6 | 95 |
| Manidda | - | 3.7 | 4.0 | 4.0 | 44.4 | 97 |
| PR Eoulim | - | 3.7 | 4.0 | 4.0 | 44.4 | 97 |
| Euddeum | - | 3.8 | 4.0 | 4.0 | 44.9 | 98 |
| Jjang | - | 3.8 | 4.0 | 4.0 | 44.9 | 98 |
| Dangchan | - | 3.8 | 4.0 | 4.0 | 44.9 | 98 |
| Daechon | - | 3.8 | 4.0 | 4.0 | 44.9 | 98 |
| Supermanidda | - | 3.8 | 4.0 | 4.0 | 44.9 | 98 |
| Hongjinju | - | 3.8 | 4.0 | 4.0 | 44.9 | 98 |
| PR Daechon | - | 3.8 | 4.0 | 4.0 | 44.9 | 98 |
| Shinjogwang | - | 4.0 | 4.0 | 4.0 | 46.0 | 100 |
| Hongiljeom | - | 4.0 | 4.0 | 4.0 | 46.0 | 100 |
| Heemangbong | - | 4.0 | 4.0 | 4.0 | 46.0 | 100 |
| PR Shinnara | - | 4.0 | 4.0 | 4.0 | 46.0 | 100 |
| PR Yeoljeong | - | 4.0 | 4.0 | 4.0 | 46.0 | 100 |
| Cheunhajeil | - | 4.0 | 4.0 | 4.0 | 46.0 | 100 |
| MC4 (control) | R | 0 | 0.7 | 1.5 | 5.8 | 13 |
| Subicho (control) | S | 3.0 | 4.0 | 4.0 | 40.5 | 88 |
a One week after transplanting, the potted plants were inoculated with R. solanacearum by cutting the roots with a scalpel, and then 20 ml of bacterial suspension (OD600=0.3) was applied to soil. The inoculated plants were incubated in a greenhouse (30°C±5°C). Seven, eleven and fifteen days after inoculation, disease index of the plants was investigated on a scale of 0-4. 0=no symptom, 1=1-25% leaves wilted, 2=26-50% leaves wilted, 3=51-75% leaves wilted, 4=76-100% leaves wilted.



 PDF Links
PDF Links PubReader
PubReader Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print